
| ||
| ||
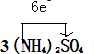 ,
,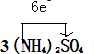 ;
; | 1 |
| 3 |
 ,故答案为:
,故答案为:| 1 |
| 3 |
 .
.


 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:
| A、SO2气体通入溴水使溴水褪色 |
| B、氯水使滴有酚酞的NaOH溶液褪色,加入NaOH后不变红 |
| C、将苯滴入溴水中振荡,溴水层褪色 |
| D、将含有碘单质的淀粉溶液,加入NaOH溶液后蓝色褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)T℃时,向1L密闭容器中投入1mol CH4和1mol H2O(g),平衡时c(CH4)=0.5mol?L-1.该温度下反应CH4(g)+H2O(g)?CO(g)+3H2(g)的平衡常数K=
(1)T℃时,向1L密闭容器中投入1mol CH4和1mol H2O(g),平衡时c(CH4)=0.5mol?L-1.该温度下反应CH4(g)+H2O(g)?CO(g)+3H2(g)的平衡常数K=查看答案和解析>>
科目:高中化学 来源: 题型:
12 6 |
13 6 |
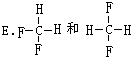
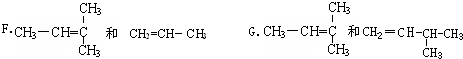
查看答案和解析>>
科目:高中化学 来源: 题型:
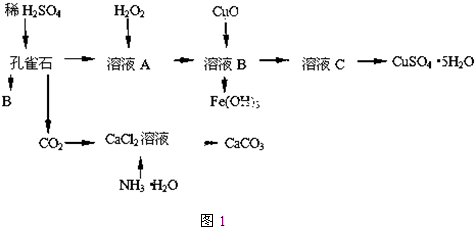
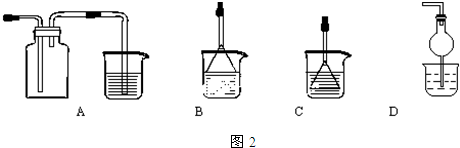
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 实验操作 | 预期现象和结论 |
| 步骤① | 取少量待测液于试管A中,滴加2mol?L-1 HCl至溶液呈酸性,加入几滴 | |
| 步骤② | 另取少量待测液于试管B中,加入 1mol?L-1 BaCl2溶液 | |
| 步骤③ | 另取少量待测液于试管C中, | 溶液分层,上层液体呈橙红色,证明待测液中很Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||


查看答案和解析>>
科目:高中化学 来源: 题型:
| A、结合质子(H+)能力:OH->CH3COO->Cl- |
| B、除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数 |
| C、F、Cl、Br的最外层电子数都是7,次外层电子数都是8 |
| D、X、Y均为短周期元素,其简单离子mXa+与nYb-的电子层结构相同,则m+a=n-b |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化还原反应中有一种元素被氧化,肯定有另一种元素被还原 |
| B、由两种不同的核素形成的共价键一定是极性共价键 |
| C、阴离子只有还原性,阳离子只有氧化性 |
| D、某元素在两种的化合物中呈现不同的化合价,这两种的化合物相互反应后,得到了该元素的单质,则该元素一定是非金属元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com