
| A. | 配制100g20%的氢氧化钠溶液(烧杯、100mL容量瓶、胶头滴管) | |
| B. | 钠的焰色反应(铂丝、硫酸钠溶液、稀盐酸) | |
| C. | 从碘水中提取碘(蒸发皿、酒精灯、玻璃棒) | |
| D. | 除去自来水中的Cl-(铁架台、玻璃棒、漏斗) |
分析 A.配制100g20%的氢氧化钠溶液,可称量后在烧杯中溶解即可;
B.铂丝用盐酸清洗后,灼烧至无色,然后蘸取硫酸钠溶液,灼烧,观察Na的焰色反应;
C.从碘水中提取碘,选择萃取装置;
D.除去自来水中的Cl-,选择蒸馏装置.
解答 解:A.配制100g20%的氢氧化钠溶液,可称量后在烧杯中溶解即可,则不需要100mL容量瓶、胶头滴管,故A不选;
B.铂丝用盐酸清洗后,灼烧至无色,然后蘸取硫酸钠溶液,灼烧,观察Na的焰色反应,则均需要,故B选;
C.从碘水中提取碘,选择萃取装置,需要分液漏斗,不需要蒸发皿、酒精灯、玻璃棒,故C不选;
D.除去自来水中的Cl-,选择蒸馏装置,需要蒸馏烧瓶、冷凝管等,不需要玻璃棒、漏斗,故D不选;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握溶液配制、混合物分离提纯实验为解答的关键,侧重分析与实验能力的考查,注意仪器的使用及实验技能,题目难度不大.


科目:高中化学 来源: 题型:解答题
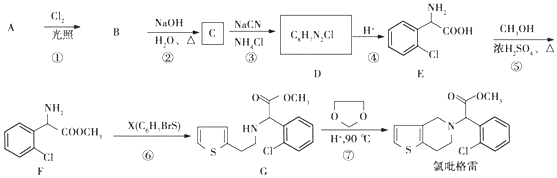
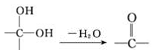 ;②
;②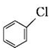 中氯原子较难水解;③RCHO$→_{NH_{4}Cl}^{NaCN}$
中氯原子较难水解;③RCHO$→_{NH_{4}Cl}^{NaCN}$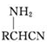
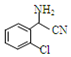 ;C分子中最多有14个原子共平面.
;C分子中最多有14个原子共平面.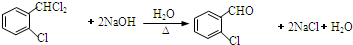 .
.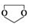 ,需要经历的反应类型有②①③④③(填写编号).①加成反应 ②消去反应 ③取代反应 ④氧化反应 ⑤还原反应,写出制备化合物
,需要经历的反应类型有②①③④③(填写编号).①加成反应 ②消去反应 ③取代反应 ④氧化反应 ⑤还原反应,写出制备化合物 的最后一步反应HOCH2CH2OH+HCHO$\stackrel{酸}{→}$
的最后一步反应HOCH2CH2OH+HCHO$\stackrel{酸}{→}$ .
.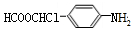 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 乙酰苯胺是一种白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂、退热剂、防腐剂和染料中间体.乙酰苯胺的制备原理为:
乙酰苯胺是一种白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂、退热剂、防腐剂和染料中间体.乙酰苯胺的制备原理为: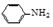 +CH3COOH?
+CH3COOH?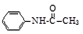 +H2O
+H2O| 名称 | 式量 | 性状 | 密度/g/cm3 | 沸点/℃ | 溶解度 | |
| 苯 胺 | 93 | 无色油状液体,具有还原性 | 1.00 | 184.4 | 微溶于水 | 易溶于乙醇、乙醚等 |
| 乙 酸 | 60 | 无色液体 | 1.05 | 118.1 | 易溶于水 | 易溶于乙醇、乙醚 |
| 乙酰苯胺 | 135 | 白色晶体 | 1.22 | 304 | 微溶于冷水,溶于热水 | 易溶于乙醇、乙醚 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用下面两种方祛可以制得白色的Fe(OH)2沉淀.
用下面两种方祛可以制得白色的Fe(OH)2沉淀.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度可以提高NO和CO的转化率 | |
| B. | 使用高效催化剂可以提高NO和CO的转化率 | |
| C. | 反应达到平衡后,NO 的生成速率和消耗速率相等 | |
| D. | 若该反应已达到平衡状态,增大压强(通过减小体积实现)对平衡无影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2是中间产物,不是催化剂 | |
| B. | 总反应速率由反应(1)决定 | |
| C. | 用不同物质表示的反应速率,数值和含义都相同 | |
| D. | 加入高效催化剂,能降低反应的活化能 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com