
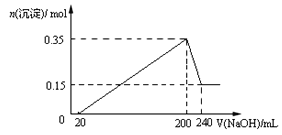
【题目】将一定质量的Mg和Al混合物投入到200mL稀硫酸中,固体全部溶解后,向所得溶液中滴加NaOH溶液至过量,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。则下列说法不正确的是( )
A. Mg和Al的总质量为9g
B. 最初20mLNaOH溶液用于中和过量的稀硫酸
C. NaOH溶液物质的量浓度为5mol·L-1
D. 生成的氢气在标准状况下的体积为11.2L
【答案】D
【解析】试题分析:从图象中看到,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中硫酸溶解Mg、Al后有剩余,此时发生的反应为:H2so4+2NaOH=Na2so4+2H2O.当V(NaOH溶液)=200mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3;
A、当V(NaOH溶液)=240mL时,沉淀不再减少,此时全部为Mg(OH)2,n(Mg)=n[Mg(OH)2]=0.15mol,
m(Mg)=0.15mol×24gmol-1=3.6g,n(Al)=n[Al(OH)3]=0.35mol-0.15mol=0.2mol,m(Al)=0.2mol×27gmol-1=5.4g,所以镁和铝的总质量为9g,A项正确,B项正确。C.从200mL到240mL,NaOH溶解Al(OH)3:NaOH+Al(OH)3=NaAlO2+2H2O,则此过程消耗n(NaOH)=n[Al(OH)3]=0.2mol,c(NaOH)="0.2mol÷0.04" L=5molL-1,C项正确;D、由Mg+H2so4=Mgso4+H2↑,2Al+3H2so4=2Al2(so4)3+3H2↑可以计算出生成n(H2)=0.45mol,标准状况下V(H2)=0.45mol×22.4Lmol-1=10.08L,D项错误。答案选D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两位同学分别设计了如图甲、乙所示的实验。下列叙述中不正确的是( )

A.图甲所示实验可通过观察产生气泡的快慢来比较反应速率的大小
B.若图甲所示实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好
C.用图乙装置测定反应速率,可测定反应产生的气体体积及反应时间
D.为检查图乙所示装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用煤油作溶剂,二(2-乙基己基)磷酸酯作流动载体,H2SO4 作内相酸处理含铜废水。 在其他条件相同时,Cu2+萃取率[萃取率=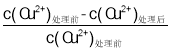 ×100% ]与初始 Cu2+浓度关系如图 1 所示;在其他条件相同时,处理前初始 Cu2+浓度为 200 mg·L-1,Cu2+萃取率与废水 pH 的关系如图 2 所示。下列说法错误的是
×100% ]与初始 Cu2+浓度关系如图 1 所示;在其他条件相同时,处理前初始 Cu2+浓度为 200 mg·L-1,Cu2+萃取率与废水 pH 的关系如图 2 所示。下列说法错误的是
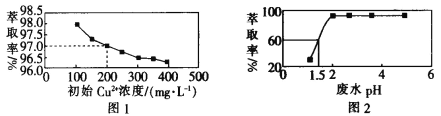
A.根据图 1 可知,废水中初始 Cu2+浓度越大,Cu2+的萃取效果越好
B.根据图 2 可知,废水初始 pH>2 时,去除 Cu2+的效果较好
C.根据图 1 可知,Cu2+初始浓度为 200 mg·L-1 时,Cu2+的萃取率为 97.0%
D.根据图 2 可知,若取 800 mL 初始 Cu2+浓度为 200 mg·L-1 的废水,在 pH=1.5 时处理废水,则处理后的废水中剩余 Cu2+的物质的量为 1.5×10-3mol(假设体积不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,不属于四大基本反应类型,但属于氧化还原反应的是
A. 2Na+2H2O===2NaOH+H2↑
B. Cl2+H2O===HCl+HClO
C. CaCO3![]() CaO+CO2↑
CaO+CO2↑
D. Ca(ClO)2+2HCl===CaCl2+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类推思维是化学解题中常用的一种思维方法,下列有关反应方程式(或离子方程式)的类推正确的是( )
已知 | 类推 | |
A | 将Fe加入CuSO4溶液中: Fe + Cu2+ = Cu + Fe2+ | 将Na加入到CuSO4溶液中: 2Na + Cu2+ = Cu + 2Na+ |
B | 稀硫酸与Ba(OH)2溶液反应至溶液呈中性: 2H++SO42﹣+Ba2++2OH﹣=BaSO4↓+2H2O | NaHSO4溶液与Ba(OH)2溶液反应呈中性: 2H++SO42﹣+Ba++2OH﹣=BaSO4↓+2H2O |
C | 铁和氯气反应2Fe+3Cl2 | 铁和单质反应2Fe+3I2 |
D | 向Ca(ClO)2溶液中通入少量CO2: Ca2++2ClO﹣+CO2+H2O=CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2: Ca2++2ClO﹣+SO2+H2O=CaSO3↓+2HClO |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酒后驾车是引发交通事故的主要原因之一。酒的主要成分是乙醇。
(1)实验室可用乙醇在一定条件下制得乙烯,写出该反应的化学方程式(要求写反应条件):____。
(2)观察如图制取乙烯和收集装置。请回答:
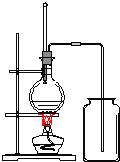
①请指出该装置中两处错误_____,____。
②圆底烧瓶中加入几片碎瓷片的作用是_____。
③写出乙烯使溴水褪色发生反应的化学方程式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法错误的是( )
A.石油和天然气的主要成分都是碳氢化合物
B.乙酸和乙酸乙酯都能与氢氧化钠溶液反应
C.糖类、油脂和蛋白质都是人体重要的营养物质
D.一定条件下,苯能发生加成反应、取代反应、氧化反应、加聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.无色透明的溶液中:Fe3+、NH4+、I-、CO32-
B.0.1molL-1KNO3溶液中:Na+、Fe2+、Cl-、SO42-
C.使酚酞变红的溶液中:Na+、Mg2+、SO32-、NH4+
D.![]() =1×10-12的溶液:K+、Na+、CO32-、HCO3-
=1×10-12的溶液:K+、Na+、CO32-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锡酸钠晶体(Na2SnO33H2O2)在染料工业用作媒染剂。以锡渣废料(主要成分是SnO,还含有少量Fe、Te、Sb、Pb、As等元素的氧化物)为原料,制备锡酸钠晶体的工艺流程图如图:
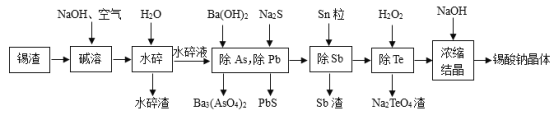
已知:水碎液中溶质的主要成分为Na2SnO3、Na3AsO4、Na3SbO4、Na2PbO2、Na2TeO3。
(1)“碱溶”时,SnO发生反应的化学方程式为___。
(2)工业上制备锡酸钠晶体(Na2SnO33H2O)时,会将“水碎渣”再次水洗,其目的是___。
(3) “除Sb”时发生反应的离子方程式为___。
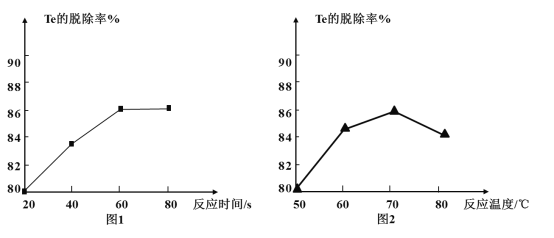
(4) “除Te”过程中氧化剂与还原剂的物质的量之比为___,该过程中反应时间、反应温度对Te的脱除率的影响关系如图,则70℃后随温度升高Te的脱除率下降的原因可能是___;“除Te”的最优反应时间和反应温度分别为___、___。
(5)已知锡酸钠的溶解度一般随着温度的升高而升高,则在“浓缩、结晶”时,加入NaOH的原因是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com