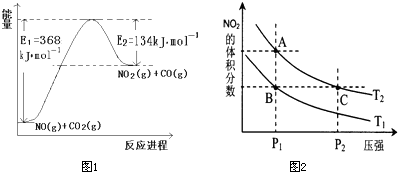
���û�ѧ��Ӧԭ���о��������ȡ���ȵ��ʼ��仯����ķ�Ӧ����Ҫ���壮
������������SO
2����������SO
3��2SO
2��g��+O
2��g��?2SO
3��g���������ϵ��SO
3�İٷֺ������¶ȵĹ�ϵ��ͼ1��ʾ���������κ�һ�㶼��ʾƽ��״̬����
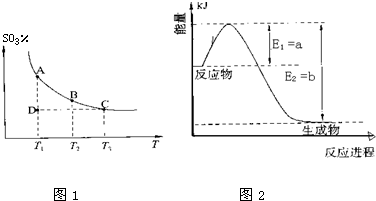
����ͼʾ�ش��������⣺
��2SO
2��g��+O
2��g��?2SO
3��g���ġ�H
��
��
0�����¶�ΪT
1��T
2����Ӧ��ƽ�ⳣ���ֱ�ΪK
1��K
2����K
1��
��
K
2������Ӧ���е�״̬Dʱ��v
����
��
v
�������������������=������
�����ں��¡�����������������ƽ����ϵ��ͨHe��V
������
����
�����������С�����䡱����ƽ��
��
��
�ƶ�������������ҡ���������
�����ں��¡���ѹ������������ƽ����ϵ��ͨ�뺤����V
����С
��С
��V
����С
��С
��ƽ��
����
����
�ƶ���
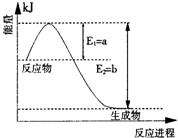
���ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���ã�
����ͼ2��һ�����¶Ⱥ�ѹǿ����N
2��H
2��Ӧ����1molNH
3�����������仯ʾ��ͼ����д����ҵ�ϳɰ����Ȼ�ѧ��Ӧ����ʽ��
N2��g��+3H2��g���T2NH3��g����H=-2��b-a��kJ?mol-1
N2��g��+3H2��g���T2NH3��g����H=-2��b-a��kJ?mol-1
����H����ֵ�ú���ĸa��b�Ĵ���ʽ��ʾ����
�ڹ�ҵ�ϳɰ��ķ�ӦΪN
2��g��+3H
2��g��
2NH
3��g������һ���¶��£���һ������N
2��H
2ͨ�뵽���Ϊ1L���ܱ������дﵽƽ��ı�������������ʹƽ��������Ӧ�����ƶ���ƽ�ⳣ���������
AB
AB
��
A������ѹǿ B������Ӧ���Ũ�� C��ʹ�ô��� D�������¶�
�۹�ҵ�ϳɰ��ķ�ӦΪN
2��g��+3H
2��g��
2NH
3��g���������ݻ�Ϊ2.0L���ܱ������г���0.60mol N
2��g����1.60mol H
2��g������Ӧ��һ�������´ﵽƽ��ʱ��NH
3���������Ϊ
�����㣺��������N
2��g��+3H
2��g��
2NH
3��g����ƽ�ⳣ��Ϊ
200
200
��N
2��ƽ��ת����Ϊ
66.7%
66.7%
��
����֪��ѧ��Ӧ��N
2��g��+3H
2��g��?2NH
3��g�����仯ѧƽ�ⳣ��K���¶�T�Ĺ�ϵ���±���
| T/�� |
200 |
300 |
400 |
| K |
K1 |
K2 |
0.5 |
400��ʱ����2L���ܱ�������2NH
3��g��?N
2��g��+3H
2��g�� �Ļ�ѧƽ�ⳣ��K��ֵΪ
2
2
�������NH
3��N
2��H
2�����ʵ����ֱ�Ϊ12mol��8mol��4molʱ����÷�Ӧ��v
����N
2��
����
����
v
����N
2��������ڡ�����С�ڡ����ڡ���





 ��ͼͼ�麮����ҵ������ҵ���ִ�ѧ������ϵ�д�
��ͼͼ�麮����ҵ������ҵ���ִ�ѧ������ϵ�д�
 ���ǵ����Ϻ����ḻ��Ԫ�أ������仯������о���������������������Ҫ���壮
���ǵ����Ϻ����ḻ��Ԫ�أ������仯������о���������������������Ҫ���壮