
| A. | 用红外光谱来测定有机物分子中不同类型的氢原子和数目 | |
| B. | CH3CH2Br中滴加AgNO3溶液观察是否有浅黄色沉淀,判断卤代烃的类型 | |
| C. | CH3CH2Cl与NaOH的乙醇溶液混合后加热,制得气体通入酸性高锰酸钾溶液中,若溶液褪色,则可检验气体中有乙烯 | |
| D. | 用酸性高锰酸钾溶液区分苯和甲苯 |
分析 A.核磁共振氢谱确定H的种类和数目;
B.CH3CH2Br中滴加AgNO3溶液不反应;
C.乙醇易挥发,乙醇与消去反应生成的乙烯均能被高锰酸钾氧化;
D.甲苯能被高锰酸钾氧化,而苯不能.
解答 解:A.核磁共振氢谱确定H的种类和数目,而红外光谱来测定有机物分子中化学键、官能团等,故A错误;
B.CH3CH2Br中滴加AgNO3溶液不反应,应水解或消去反应后加酸至酸性,再加硝酸银检验,故B错误;
C.乙醇易挥发,乙醇与消去反应生成的乙烯均能被高锰酸钾氧化,则溶液褪色,不能检验乙烯,故C错误;
D.甲苯能被高锰酸钾氧化,而苯不能,则用酸性高锰酸钾溶液区分苯和甲苯,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握有机物的结构与性质、有机物的鉴别为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:实验题
 通过煤的气化和液化,使碳及其化合物得以广泛应用.
通过煤的气化和液化,使碳及其化合物得以广泛应用.| t/min | 0 | 1 | 2 | 3 | 4 |
| n(H2O)/mol | 0.600 | 0.520 | 0.450 | 0.350 | 0.350 |
| n(CO)/mol | 0.400 | 0.320 | 0.250 | 0.150 | 0.150 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
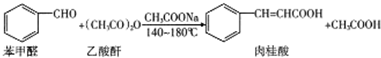
| 名称 | 分子量 | 相对密度 | 熔点 | 沸点 | 溶解度 |
| 苯甲醛 | 106 | 1.04 | -26 | 179.62 | 微溶于水,可混溶于乙醇、乙醚、苯 |
| 乙酸酐 | 102 | 1.080 | -73.1 | 138.6 | 溶于乙醚,易水解形成乙酸. |
| 肉桂酸 | 148 | 1.247 | 135 | 300 | 微溶于水,可以溶于苯、丙酮、乙醚、乙醇等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的最高价氧化物对应水化物的酸性比Y的最高价氧化物对应水化物的酸性强 | |
| B. | X原子的得电子能力比Y原子的得电子能力强 | |
| C. | X的阴离子的还原性比Y的阴离子的还原性强 | |
| D. | X的气态氢化物比Y的气态氢化物稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3:0.12 mol•L-1 | B. | H2O:0.09 mol•L-1 | ||
| C. | NO:0.03 mol•L-1 | D. | O2:0.15 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl的摩尔质量是58.5 g | |
| B. | 0.5 mol CO2气体中所含的CO2分子数约为3.01×1023 | |
| C. | 标准状况下,6.02×1022个CO2分子所占的体积约是22.4 L | |
| D. | 在1 L水中溶解5.85g NaCl,即可配制得0.1 mol•L-1的NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
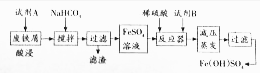
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com