
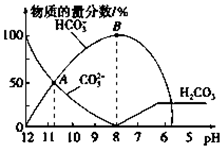
 常温下,在10mL0.1mol•L-1Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是( )
常温下,在10mL0.1mol•L-1Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是( )| A. | 在A点所示的溶液中:c(CO32-)=c(HCO3-)>c(H+)>c(OH-) | |
| B. | 当溶液的pH为7时,溶液的总体积大于20mL | |
| C. | 在B点所示的溶液中,浓度最大的离子是HCO3- | |
| D. | 在0.1 mol•L-1 Na2CO3溶液中:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
分析 A.根据图象分析,c(HCO3-)=c(CO32-),溶液呈碱性,则c(OH-)>c( H+).
B.当混合溶液体积为20mL时,二者恰好反应生成NaHCO3,HCO3-的电离程度小于其水解程度,所以其溶液呈碱性;
C.根据电荷守恒判断各离子浓度大小;
D.依据电荷守恒解答.
解答 解:A.根据图象分析,A点为碳酸钠和碳酸氢钠的混合溶液,且c(HCO3-)=c(CO32-),溶液呈碱性,则c(OH-)>c( H+),盐溶液水解程度较小,所以c(CO32-)>c(OH-),则离子浓度大小顺序是c(HCO3-)=c(CO32-)>c(OH-)>c( H+),故A错误;
B.当混合溶液体积为20mL时,二者恰好反应生成NaHCO3,HCO3-的电离程度小于其水解程度,所以其溶液呈碱性,要使混合溶液呈中性,则酸稍微过量,所以混合溶液体积稍微大于20mL,故B正确;
C.B点溶液呈碱性,溶液中存在电荷守恒:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)+c(Cl-),由于氢离子浓度较小,则离子浓度最大的为钠离子,故C错误;
D.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),故D错误;
故选B.
点评 本题考查了离子浓度大小的比较,题目难度中等,明确反应后溶质组成为解答关键,注意根据物料守恒、电荷守恒进行分析解答,试题侧重考查学生的分析、理解能力.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:解答题
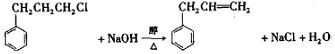
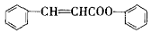 )是合成高聚酚酯的原料,其合成路线(部分反应条件略去)如图所示:
)是合成高聚酚酯的原料,其合成路线(部分反应条件略去)如图所示:
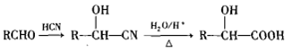
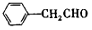 .
. .
. .
. 或
或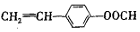 .(任写一种)
.(任写一种)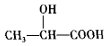 )的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).
)的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol任何物质都约含有6.02×1023个原子 | |
| B. | 物质的量为2mol的BaCl2中,含有Cl-个数为2NA | |
| C. | O2的摩尔质量是32 | |
| D. | 摩尔是物质的量的单位 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
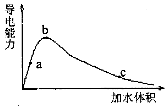 一定温度下,将一定量的冰醋酸加水稀释,稀释过程中溶液的导电性变化如图所示.则下列说法错误的是( )
一定温度下,将一定量的冰醋酸加水稀释,稀释过程中溶液的导电性变化如图所示.则下列说法错误的是( )| A. | 醋酸的电离度:c<b<a | |
| B. | 溶液的PH值:b<a<c | |
| C. | 蘸取a点溶液滴在湿润的PH试纸上,测得PH值一定偏大 | |
| D. | 若分别取a、b、c三点的溶液各10mL,各用同浓度的氢氧化钠溶液中和,消耗NaOH溶液的体积a=b=c |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaSO4(s)+4C(s)═BaS(s)+4CO(g)室温下不能自发进行,说明该反应的△H<0 | |
| B. | 为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解 | |
| C. | 己知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3kJ•mol-1,则水电离的热化学方程式为:H2O(l)?H+ (aq)+OH-(aq)△H=+57.3 kJ•mol-1 | |
| D. | 向0.1mol/L的CH3COONa溶液中加入少量醋酸钠固体,c(CH3COO-)/c(Na+ )变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应掉的三种金属的质量相等 | B. | 反应后三种金属质量相等 | ||
| C. | 所用盐酸均过量 | D. | 三种金属可以都有剩余 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com