
【题目】常温下,向25 mL0.12 mol/L AgNO3溶液中逐滴加入浓度为2%的氨水,先出现沉淀,继续滴加沉淀溶解。该过程中加入氨水的体积V与溶液中lg 的关系如图所示。已知e点时溶液迅速由浑浊变得澄清,且此时溶液中c(Ag+)与c(NH3)均约为2×10-3 mol/L。下列叙述不正确的是( )
的关系如图所示。已知e点时溶液迅速由浑浊变得澄清,且此时溶液中c(Ag+)与c(NH3)均约为2×10-3 mol/L。下列叙述不正确的是( )

A.a点溶液呈酸性的原因是AgNO3水解
B.b点溶液中:c(Ag+)+c[Ag(NH3)2+]<c(NO3-)
C.由e点可知,反应Ag++2NH3![]() [Ag(NH3)2]+平衡常数的数量级为105
[Ag(NH3)2]+平衡常数的数量级为105
D.c~d段加入的氨水主要用于沉淀的生成和溶解
【答案】C
【解析】
A.AgNO3是强酸弱碱盐,在溶液中Ag+发生水解反应,消耗水电离产生的OH-,使水的电离平衡正向移动,最终达到平衡时,溶液中c(H+)>c(OH-),使溶液显酸性,A正确;
B.b点溶液存在电荷守恒:c(Ag+)+c[Ag(NH3)2+]+c(H+)+c(NH4+)=c(NO3-)+c(OH-),由于此时lg =0,则c(H+)=c(OH-),所以c(Ag+)+c[Ag(NH3)2+]<c(NO3-),B正确;
=0,则c(H+)=c(OH-),所以c(Ag+)+c[Ag(NH3)2+]<c(NO3-),B正确;
C.反应Ag++2NH3![]() [Ag(NH3)2]+平衡常数K=
[Ag(NH3)2]+平衡常数K=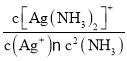 ,忽略Ag+的水解和[Ag(NH3)2]+的电离作用,c{[Ag(NH3)2]+}=
,忽略Ag+的水解和[Ag(NH3)2]+的电离作用,c{[Ag(NH3)2]+}=![]() -2×10-3 mol/L≈0.1 mol/L,带入平衡常数表达式,计算可得K=1.25×107,所以其数量级为107,C错误;
-2×10-3 mol/L≈0.1 mol/L,带入平衡常数表达式,计算可得K=1.25×107,所以其数量级为107,C错误;
D.c~d段lg 变化较小,说明加入的氨水主要用于Ag2O沉淀的生成和溶解,D正确;
变化较小,说明加入的氨水主要用于Ag2O沉淀的生成和溶解,D正确;
故合理选项是C。


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】在0.4L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题:

(1)该混合液中,NaCl的物质的量为__mol,含溶质MgCl2的质量为__g。
(2)该混合液中CaCl2的物质的量为__mol,将该混合液加水稀释至体积为1L,稀释后溶液中Ca2+的物质的量浓度为__mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
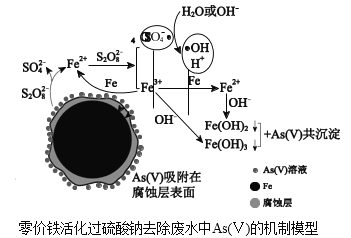
【题目】水体砷污染已成为一个亟待解决的全球性环境问题,我国科学家研究零价铁活化过硫酸钠(Na2S2O8)去除废水中的正五价砷[As(Ⅴ)],其机制模型如图。
资料:
Ⅰ.酸性条件下SO![]() 为主要的自由基,中性及弱碱性条件下SO
为主要的自由基,中性及弱碱性条件下SO![]() ·和·OH同时存在,强碱性条件下·OH为主要的自由基。
·和·OH同时存在,强碱性条件下·OH为主要的自由基。
Ⅱ.Fe2+、Fe3+形成氢氧化物沉淀的pH
离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe2+ | 7.04 | 9.08 |
Fe3+ | 1.87 | 3.27 |
(1)砷与磷在元素周期表中位于同一主族,其原子比磷多一个电子层。
①砷在元素周期表中的位置是_____。
②砷酸的化学式是_____,其酸性比H3PO4_____(填“强”或“弱”)。
(2)零价铁与过硫酸钠反应,可持续释放Fe2+,Fe2+与S2O![]() 反应生成Fe3+和自由基,自由基具有强氧化性,利于形成Fe2+和Fe3+,以确保As(Ⅴ)去除完全。
反应生成Fe3+和自由基,自由基具有强氧化性,利于形成Fe2+和Fe3+,以确保As(Ⅴ)去除完全。
①零价铁与过硫酸钠反应的离子方程式是_____。
②Fe3+转化为Fe2+的离子方程式是_____。
③SO![]() ·和H2O反应的离子方程式是_____。
·和H2O反应的离子方程式是_____。
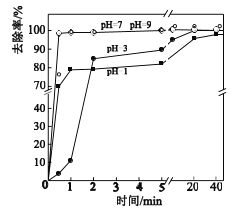
(3)不同pH对As(Ⅴ)去除率的影响如图。5min内pH=7和pH=9时去除率高的原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,水存在如下电离:H2O![]() H++OH- H>0,下列叙述正确的是
H++OH- H>0,下列叙述正确的是
A.向水中滴入少量稀盐酸,平衡逆向移动,Kw减小
B.将水加热,Kw增大,pH减小
C.向水中加入少量固体NH4Cl,平衡逆向移动,c(H+)降低
D.向水中加入少量固体硫酸钠,c(H+)=10-7mol/L,Kw不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法不正确的是
A. 6.02×1023就是阿伏加德罗常数
B. 1 mol水中的氢原子数目为2NA
C. 阿伏加德罗常数个粒子的物质的量是1 mol
D. 1 mol 氨气所含原子数约为2.408×1024个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水四氯化锡(SnC14)是一种用途广泛的化工中间体,常用作媒染剂和有机合成的氯化催化剂。熔融的金属锡(熔点231℃)在300℃左右能直接与Cl2作用生成无水四氯化锡,实验室装置如图所示:

已知信息如下:①将金属锡熔融,通人干燥氯气进行反应,生成四氯化锡。②无水四氯化锡是无色易流动的液体,熔点为一33℃,沸点为114.1℃。二氯化锡是无色晶体,熔点为246℃,沸点为652℃。③无水四氯化锡在空气中极易水解,水解产物之一是SnO2.xH2O,并产生白烟。请回答下列问题:
(l)开始实验前一定要____,E中冷水的作用是 ___。
(2)装置F中盛放的最佳试剂为 ___,作用是____。
(3)实验时应先打开A处分液漏斗旋塞和整套装置的阀门,待观察到____这一现象时,再点燃D处酒精灯。
(4)若撤去装置C,则D中还可能发生反应的化学方程式为 __。
(5) Cl2和锡作用即可生成SnC14,也会生成SnCl2,为减少SnCl2的生成,可采取的措施是 _______ .
(6)得到的产物中常含有杂质SnCl2,SnCl2是常用的还原剂。某实验小组用碘氧化法滴定分析产品中杂质SnCl2的质量分数。准确称取a克该样品于锥形瓶,用适量浓盐酸溶解,淀粉溶液作指示剂,c mol.L-l碘标准溶液滴定至终点,消耗标准液20. 00mL,已知滴定原理是:SnCl2+2HCl+I2=SnC14+2HI,则产品中杂质SnCl2的质量分数为____(用含a、c的代数式表示);即使此法测定的操作均正确,但测得的SnCl2含量仍低于实际含量,其原因可能是________(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅、锗(32Ge,熔点 937℃)和镓(31Ga)都是重要的半导体材料,在航空航天测控、核物理探测、光纤通讯、红外光学、太阳能电池、化学催化剂、生物医学等领域都有广泛而重要的应用。锗与硅是同主族元素。
(1)硅在元素周期表中的位置是________。
(2)硅和锗与氯元素都能形成氯化物 RCl4(R代表Si和Ge),从原子结构角度解释原因 _______。
(3)自然界矿石中锗浓度非常低,因此从锗加工废料(含游离态锗)中回收锗是一种非常重要的方法。如图是一种提取锗的流程:
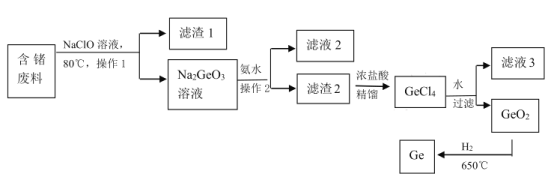
①NaClO 溶液浸取含锗废料中的锗时发生反应的离子方程式为_____;为了加NaClO 溶液浸取含锗废料的速率,可以采取的措施有_____。
②操作 1 和操作 2 是____。
③ GeO2 的熔点为 1086℃,利用氢气还原GeO2,每生成 146kg 的锗放出 akJ 的热量,该反应的热化学方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在催化剂作用下,用乙醇制乙烯,乙醇转化率和乙烯选择性(生成乙烯的物质的量与乙醇转化的物质的量的比值)随温度、乙烯进料量(单位: ![]() )的关系如图所示(保持其他条件相同)。
)的关系如图所示(保持其他条件相同)。
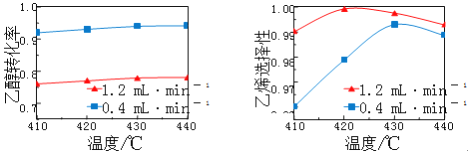
在410~440℃温度范围内,下列说法不正确的是
A. 当乙醇进料量一定,随乙醇转化率增大,乙烯选择性升高
B. 当乙醇进料量一定,随温度的升高,乙烯选择性不一定增大
C. 当温度一定,随乙醇进料量增大,乙醇转化率减小
D. 当温度一定,随乙醇进料量增大,乙烯选择性增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙作指示剂。请填写下列空白:
I.(1)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视_________。直到因加入一滴盐酸后,溶液由黄色变为橙色,即到达滴定终点。
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是_______________
A 酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B 滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C 酸式滴定管在滴定前有气泡,滴定后气泡消失
D 读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
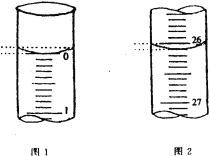
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示:则起始读数为_________mL,终点读数为_____________mL;所用盐酸溶液的体积为______________mL。
(4)某学生根据三次实验分别记录有关数据如下表:
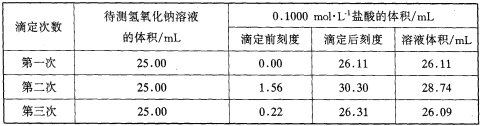
请选用其中合理的数据列式计算该氢氧化钠溶液的物质的量浓度(保留4位小数):c(NaOH)______
II.有H+浓度相同、体积相等的三种酸:a、盐酸b、硫酸 c、醋酸,同时加入足量的锌,则开始反应时速率_____________反应完全后生成H2的质量 ___________(用<、=、> 表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com