
某一反应体系中存在下列6种物质:NO、FeSO4、Fe(NO3)3、HNO3、Fe2(SO4)3,和H2O.已知存在下列转化关系:HNO3→NO,请完成下列各题:
(1)该反应的还原剂 ;
(2)反应中1mol氧化剂 (填“得到”或“失去”) mol电子.
(3)当有0.1mol HNO3被还原,此时生成标准状况下NO的体积是 L.
(4)请完成该反应的化学方程式:
+ 3FeSO4 = Fe2(SO4)3 + Fe(NO3)3 + + 2 H2O.
考点:
氧化还原反应的计算;氧化还原反应方程式的配平.
专题:
氧化还原反应专题.
分析:
所给的物质组合中,HNO3中氮元素化合价位于最高价,具有氧化性,对应还原产物为NO,能将还原性的FeSO4氧化为Fe2(SO4)3,根据氢原子守恒,水在生成物中,根据化合价升降相等和原子守恒配平后发生的反应,以此解答该题.
解答:
解:(1)氧化还原反应的特征为化合价的升降,反应中HNO3为反应物,具有强氧化性,则NO为生成物,反应中硝酸被还原,为氧化剂,题给物质中元素化合价发生变化的还有Fe,则Fe元素化合价应升高,被氧化,则FeSO4应为还原剂,被氧化生成Fe(NO3)3和Fe2(SO4)3,故答案为:FeSO4;
(2)硝酸为氧化剂,在反应中得到电子,由化合价变化可知N元素化合价由+5价降低到+2价,则1mol硝酸反应得到3mol电子,故答案为:得到;3;
(3)当有0.1mol HNO3被还原,此时生成NO是0.1mol,在标准状况下NO的体积是2.24L,故答案为:2.24;
(4)根据电子守恒,氮元素的化合价降低了3价,铁元素化合价升高了1价,根据得失电子守恒以及元素守恒,所以硫酸亚铁前边系数是3,硝酸前系数是4,水的前边系数是2,方程式为:4HNO3+3FeSO4=Fe(NO3)3+Fe2(SO4)3+NO↑+2H2O
故答案为:4HNO3;3FeSO4;Fe2(SO4)3;Fe(NO3)3;NO↑;2.
点评:
本题考查氧化还原反应化学方程式的书写,侧重于从化合价分析氧化产物和还原产物,从原子守恒确定其他反应物或产物,根据根据电子守恒和质量守恒来配平方程式,题目难度中等.


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
HNO3与金属反应时,还原产物可能是NO2、NO、N2O、N2或NH3的一种或几种.现有一定量的Al粉和Fe粉的混合物与100mL,稀HNO3充分反应,反应过程中无任何气放出.在反应结束后的溶液中,逐渐加入4mol•L﹣1的NaOH溶液,加入NaOH溶液的体积(mL)与产生沉淀的物质的量关系如图.请回答:
(1)与HNO3反应后Fe元素的化合价是
(2)纵坐标中A点数值是 ,B点数值是 ,原HNO3浓度是 .

查看答案和解析>>
科目:高中化学 来源: 题型:
下表为元素周期表的一部分,a、b、c…为部分元素.回答下列问题:
| a |
| ||||||||||||||||
| b | c | d | e |
| |||||||||||||
| f | g |
| |||||||||||||||
| h | i |
(1)请写出上述元素h的原子结构示意图 ;
(2)比较e、g两种元素的气态氢化物的稳定性大小 (写化学式,下同);e、g两种元素的气态氢化物熔、沸点较高的是 ,其原为 ;
(3)b2a2分子的电子式是 ,该分子中存在的σ键与π键的个数比为 ;
(4)c、d两种元素中第一电离能较大的是 (写元素符号),其原因是
;
(5)已知f的氢氧化物与水电离出的OH﹣可形成配位键,则生成的含有配位键的离子的结构式为 (标出配位键).
查看答案和解析>>
科目:高中化学 来源: 题型:
标准状况下有①6.72LCH4 ②3.01×1023个HCl ③13.6gH2S ④0.2molNH3,下列对四种气体的关系从小到大表示不正确的是( )
|
| A. | 体积 ④<①<②<③ | B. | 密度 ①<④<③<② |
|
| C. | 质量 ④<①<③<② | D. | 氢原子数 ②<④<③<① |
查看答案和解析>>
科目:高中化学 来源: 题型:
(2014秋•香坊区校级期中)从①渗析、②聚沉、③丁达尔效应 ④凝胶、⑤布朗运动、⑥电泳、中选出适当的序号填入下列每小题后面的空格中:
(1)用半透膜把制取的Fe(OH)3胶体中生成的氯化钠分离的方法叫做 .
(2)在肥皂水中透过强光,可见到光带,这种现象称为 .
(3)在Fe(OH)3胶体中加入(NH4)2SO4,产生红褐色沉淀,这种现象叫做 .
(4)在水泥厂和冶金厂常用高压电对气溶胶作用,除去大量烟尘,以减小对空气的污染.这种做法应用的主要原理是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
对于某些离子的检验及结论一定正确的是( )
|
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32﹣ |
|
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42﹣ |
|
| C. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ |
|
| D. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
夏日的夜晚,常看见儿童手持发光的“魔棒”在广场上嬉戏.“魔棒”发光原理是利用过氧化氢氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式如图.下列说法正确的是( )
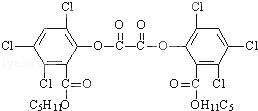
|
| A. | 草酸二酯的分子式为C26H22Cl6O8 |
|
| B. | 1mol草酸二酯与氢氧化钠稀溶液反应时(苯环上卤素不水解),最多消耗6molNaOH |
|
| C. | 草酸二酯水解可以得到两种有机物 |
|
| D. | 1mol草酸二酯与氢气完全反应,需要氢气10mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z的原子序数依次增大,Y为IA族元素,X与Z同主族,3种元素原子的最外层电子数之和为13.下列判断正确的是( )
|
| A. | Y元素位于第2周期 |
|
| B. | Y、Z均能与X形成不只一种化合物 |
|
| C. | X是ⅤA族元素 |
|
| D. | 氢化物的稳定性:HnZ>HnX |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com