
ЁОЬтФПЁПДгЙХжСНёЃЌЬњМАЦфЛЏКЯЮядкШЫРрЩњВњЩњЛюжаЕФзїгУЗЂХЃСЫОоДѓБфЛЏЁЃ
![]() ЙХДњжаЙњЫФДѓЗЂУїжЎвЛЕФжИФЯеыЪЧгЩДѓШЛДХЪЏжЦГЩЕФЃЌЦфжївЊГЩЗжЪЧ______
ЙХДњжаЙњЫФДѓЗЂУїжЎвЛЕФжИФЯеыЪЧгЩДѓШЛДХЪЏжЦГЩЕФЃЌЦфжївЊГЩЗжЪЧ______![]() ЬюзжФИађКХ
ЬюзжФИађКХ![]() ЁЃ
ЁЃ
![]()
![]()
![]()
![]()
![]() СђЫсдќЕФжївЊЛЏбЇГЩЗжЮЊЃК
СђЫсдќЕФжївЊЛЏбЇГЩЗжЮЊЃК![]() дМ
дМ![]() ЃЌ
ЃЌ![]() дМ
дМ![]() ЃЌ
ЃЌ![]() дМ
дМ![]() ЃЌMgOдМ
ЃЌMgOдМ![]() гУИУЗЯдќжЦШЁвЉгУИЈСЯвЛКьбѕЛЏЬњЕФЩЯвеСїГЬШчЯТ
гУИУЗЯдќжЦШЁвЉгУИЈСЯвЛКьбѕЛЏЬњЕФЩЯвеСїГЬШчЯТ![]() ВПЗжВйзїКЭЬѕМўТд
ВПЗжВйзїКЭЬѕМўТд![]() ЃК
ЃК
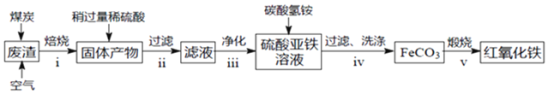 ЛиД№ЯТСаЮЪЬтЃК
ЛиД№ЯТСаЮЪЬтЃК
![]() дкВНжшiжаВњЩњЕФгаЖОЦјЬхПЩФмга______ЁЃ
дкВНжшiжаВњЩњЕФгаЖОЦјЬхПЩФмга______ЁЃ
![]() дкВНжшiiВйзїжаЃЌвЊГ§ШЅЕФРызгжЎвЛЮЊ
дкВНжшiiВйзїжаЃЌвЊГ§ШЅЕФРызгжЎвЛЮЊ![]() ШєГЃЮТЪБ
ШєГЃЮТЪБ![]() ЃЌДЫЪБРэТлЩЯНЋ
ЃЌДЫЪБРэТлЩЯНЋ![]() ГСЕэЭъШЋЃЌдђШмвКЕФpHЮЊ______ЁЃ
ГСЕэЭъШЋЃЌдђШмвКЕФpHЮЊ______ЁЃ
![]() ВНжшivжаЃЌЩњГЩ
ВНжшivжаЃЌЩњГЩ![]() ЕФРызгЗНГЬЪНЪЧ______ЁЃ
ЕФРызгЗНГЬЪНЪЧ______ЁЃ
![]() ТШЛЏЬњШмвКГЦЮЊЛЏбЇЪдМСжаЕФЁАЖрУцЪжЁБЃЌЯђТШЛЏЭКЭТШЛЏЬњЕФЛьКЯШмвКжаМгШыбѕЛЏЭЗлФЉЛсВњЩњаТЕФГСЕэЃЌаДГіИУГСЕэЕФЛЏбЇЪН______ЁЃЧыгУЦНКтвЦЖЏЕФдРэЃЌНсКЯБивЊЕФРызгЗНГЬЪНЃЌЖдДЫЯжЯѓзїГіНтЪЭЃК______ЁЃ
ТШЛЏЬњШмвКГЦЮЊЛЏбЇЪдМСжаЕФЁАЖрУцЪжЁБЃЌЯђТШЛЏЭКЭТШЛЏЬњЕФЛьКЯШмвКжаМгШыбѕЛЏЭЗлФЉЛсВњЩњаТЕФГСЕэЃЌаДГіИУГСЕэЕФЛЏбЇЪН______ЁЃЧыгУЦНКтвЦЖЏЕФдРэЃЌНсКЯБивЊЕФРызгЗНГЬЪНЃЌЖдДЫЯжЯѓзїГіНтЪЭЃК______ЁЃ
![]() ЙХРЯЖјЩёЦцЕФРЖЩЋШОСЯЦеТГЪПРЖЕФКЯГЩЗНЗЈШчЯТЃК
ЙХРЯЖјЩёЦцЕФРЖЩЋШОСЯЦеТГЪПРЖЕФКЯГЩЗНЗЈШчЯТЃК

ИДЗжНтЗДгІiiЕФРызгЗНГЬЪНЪЧ______ЁЃ
![]() ШчНёЛљгкЦеТГЪПРЖКЯГЩдРэПЩМьВтЪГЦЗжа
ШчНёЛљгкЦеТГЪПРЖКЯГЩдРэПЩМьВтЪГЦЗжа![]() ЃЌЗНАИШчЯТЃК
ЃЌЗНАИШчЯТЃК
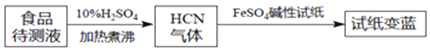
ШєЪджНБфРЖдђжЄУїЪГЦЗжаКЌга![]() ЃЌЧыНтЪЭМьВтЕФдРэЃК______ЁЃ
ЃЌЧыНтЪЭМьВтЕФдРэЃК______ЁЃ
ЁОД№АИЁП![]()
![]() ЁЂ
ЁЂ![]() ЕШ
ЕШ ![]()
![]()
![]()
![]() ЃЌМгШыCuOгы
ЃЌМгШыCuOгы![]() ЗДгІЩњГЩ
ЗДгІЩњГЩ![]() КЭ
КЭ![]() ЃЌНЕЕЭСЫ
ЃЌНЕЕЭСЫ![]() ХЈЖШЃЌЪЙЕУЫЎНтЦНКте§ЯђвЦЖЏЃЌЩњГЩ
ХЈЖШЃЌЪЙЕУЫЎНтЦНКте§ЯђвЦЖЏЃЌЩњГЩ![]() ГСЕэ
ГСЕэ ![]() МюадЬѕМўЯТЃЌ
МюадЬѕМўЯТЃЌ![]() гы
гы![]() НсКЯЩњГЩ
НсКЯЩњГЩ![]() ЁЂ
ЁЂ![]() БЛПеЦјжа
БЛПеЦјжа![]() бѕЛЏЩњГЩ
бѕЛЏЩњГЩ![]() ЁЂ
ЁЂ![]() гы
гы![]() ЗДгІЩњГЩЦеТГЪПРЖЪЙЪджНЯдРЖЩЋ
ЗДгІЩњГЩЦеТГЪПРЖЪЙЪджНЯдРЖЩЋ
ЁОНтЮіЁП
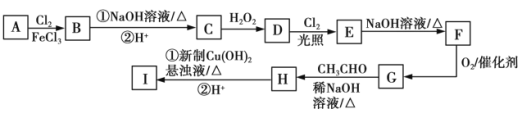
ЃЈ1ЃЉЬьШЛДХЪЏГЩЗжЮЊЫФбѕЛЏШ§ЬњЃЛ
ЃЈ2ЃЉЙЄвЕЗЯдќжївЊКЌFe2O3МАЩйСПSiO2ЁЂA12O3ЁЂMgOЕШдгжЪЃЌМгУКШМЩеПЩЩњГЩCOЁЂSO2ЕШгаЖОЦјЬхЃЌМгСђЫсКѓжЛгаЖўбѕЛЏЙшВЛЗДгІЃЌЙ§ТЫГ§ШЅЖўбѕЛЏЙшЃЌШЛКѓЕїНкpHЃЌFe3+КЭAl3+ЭъШЋзЊЛЏЮЊГСЕэЃЌЖјбЧЬњРызгУЛгазЊЛЏЮЊГСЕэЃЌЯђТЫвКМгШыЬМЫсЧтяЇНЋШмвКжаFe2+зЊБфЮЊЬМЫсбЧЬњГСЕэЃЌЙ§ТЫЕУЕНAЮЊЬМЫсбЧЬњЃЌашвЊЯДЕгЁЂИЩдяЃЌШЛКѓМгШШЕУЕНбѕЛЏЬњЃЛ
ЃЈ3ЃЉFe3+ЛсЫЎНтВњЩњНЯЖрЕФH+ЃКFe3++3H2O![]() FeЃЈOHЃЉ3+3H+ЃЌМгШыCuOгыH+ЗДгІЩњГЩCu2+КЭH2OЃЌНЕЕЭСЫH+ХЈЖШЃЌЪЙЕУЫЎНтЦНКте§ЯђвЦЖЏЃЌЩњГЩFeЃЈOHЃЉ3ГСЕэЃЌCuOДйНјЬњРызгЫЎНтЃЛ
FeЃЈOHЃЉ3+3H+ЃЌМгШыCuOгыH+ЗДгІЩњГЩCu2+КЭH2OЃЌНЕЕЭСЫH+ХЈЖШЃЌЪЙЕУЫЎНтЦНКте§ЯђвЦЖЏЃЌЩњГЩFeЃЈOHЃЉ3ГСЕэЃЌCuOДйНјЬњРызгЫЎНтЃЛ
ЃЈspan>4ЃЉЂйЬњРызггы[FeЃЈCNЃЉ6]4-ЗДгІЩњГЩFe4[FeЃЈCNЃЉ6]3ГСЕэЃЛ
ЂкШєЪджНБфРЖдђжЄУїЪГЦЗжаКЌгаCN-ЃЌFe2+гыCN-НсКЯЩњГЩ[FeЃЈCNЃЉ6]4-ЃЛFe2+БЛПеЦјжаO2бѕЛЏЩњГЩFe3+ЃЛ[FeЃЈCNЃЉ6]4- гыFe3+ЗДгІЩњГЩЦеТГЪПРЖЪЙЪджНЯдРЖЩЋЁЃ
![]() ЙХДњжаЙњЫФДѓЗЂУїжЎвЛЕФЫОФЯЪЧгЩЬьШЛДХЪЏжЦГЩЕФЃЌДХЬњГЩЗжжївЊЪЧЫФбѕЛЏШ§ЬњЃЛ
ЙХДњжаЙњЫФДѓЗЂУїжЎвЛЕФЫОФЯЪЧгЩЬьШЛДХЪЏжЦГЩЕФЃЌДХЬњГЩЗжжївЊЪЧЫФбѕЛЏШ§ЬњЃЛ
ЙЪД№АИЮЊЃКcЃЛ
![]() гЩЗжЮіПЩжЊЃЌЁАЛЙдБКЩеЁБжаВњЩњЕФгаЖОЦјЬхПЩФмгаCOЁЂ
гЩЗжЮіПЩжЊЃЌЁАЛЙдБКЩеЁБжаВњЩњЕФгаЖОЦјЬхПЩФмгаCOЁЂ![]() ЕШЃЛ
ЕШЃЛ
ЙЪД№АИЮЊЃКCOЁЂ![]() ЕШЃЛ
ЕШЃЛ
![]() ГЃЮТЪБ
ГЃЮТЪБ![]() ЃЌДЫЪБРэТлЩЯНЋ
ЃЌДЫЪБРэТлЩЯНЋ![]() ГСЕэЭъШЋЃЌ
ГСЕэЭъШЋЃЌ![]() ЃЌдђ
ЃЌдђ![]() ЃЌ
ЃЌ![]() ЃЛ
ЃЛ
ЙЪД№АИЮЊЃК5ЃЛ
![]() ЩњГЩ
ЩњГЩ![]() ЕФРызгЗНГЬЪНЪЧЃК
ЕФРызгЗНГЬЪНЪЧЃК![]() ЃЛ
ЃЛ
ЙЪД№АИЮЊЃК![]() ЃЛ
ЃЛ
![]() вђЮЊ
вђЮЊ![]() ЛсЫЎНтВњЩњНЯЖрЕФ
ЛсЫЎНтВњЩњНЯЖрЕФ![]() ЃК
ЃК![]() ЃЌМгШыCuOгы
ЃЌМгШыCuOгы![]() ЗДгІЩњГЩ
ЗДгІЩњГЩ![]() КЭ
КЭ![]() ЃЌНЕЕЭСЫ
ЃЌНЕЕЭСЫ![]() ХЈЖШЃЌЪЙЕУЫЎНтЦНКте§ЯђвЦЖЏЃЌЩњГЩ
ХЈЖШЃЌЪЙЕУЫЎНтЦНКте§ЯђвЦЖЏЃЌЩњГЩ![]() ГСЕэЃЛ
ГСЕэЃЛ
ЙЪД№АИЮЊЃК![]() ЃЛ
ЃЛ![]() ЃЌМгШыCuOгы
ЃЌМгШыCuOгы![]() ЗДгІЩњГЩ
ЗДгІЩњГЩ![]() КЭ
КЭ![]() ЃЌНЕЕЭСЫ
ЃЌНЕЕЭСЫ![]() ХЈЖШЃЌЪЙЕУЫЎНтЦНКте§ЯђвЦЖЏЃЌЩњГЩ
ХЈЖШЃЌЪЙЕУЫЎНтЦНКте§ЯђвЦЖЏЃЌЩњГЩ![]() ГСЕэЃЛ
ГСЕэЃЛ
![]() ИДЗжНтЗДгІiiЕФРызгЗНГЬЪНЮЊЃК
ИДЗжНтЗДгІiiЕФРызгЗНГЬЪНЮЊЃК![]() ЃЛ
ЃЛ
ЙЪД№АИЮЊЃК![]() ЃЛ
ЃЛ
![]() ЛљгкЦеТГЪПРЖКЯГЩдРэПЩМьВтЪГЦЗжа
ЛљгкЦеТГЪПРЖКЯГЩдРэПЩМьВтЪГЦЗжа![]() ЃЌМюадЬѕМўЯТЃЌ
ЃЌМюадЬѕМўЯТЃЌ![]() гы
гы![]() НсКЯЩњГЩ
НсКЯЩњГЩ![]() ЃЛ
ЃЛ![]() БЛПеЦјжа
БЛПеЦјжа![]() бѕЛЏЩњГЩ
бѕЛЏЩњГЩ![]() ЃЛ
ЃЛ![]() гы
гы![]() ЗДгІЩњГЩЦеТГЪПРЖЪЙЪджНЯдРЖЩЋЃЛ
ЗДгІЩњГЩЦеТГЪПРЖЪЙЪджНЯдРЖЩЋЃЛ
ЙЪД№АИЮЊЃКМюадЬѕМўЯТЃЌ![]() гы
гы![]() НсКЯЩњГЩ
НсКЯЩњГЩ![]() ЃЛ
ЃЛ![]() БЛПеЦјжа
БЛПеЦјжа![]() бѕЛЏЩњГЩ
бѕЛЏЩњГЩ![]() ЃЛ
ЃЛ![]() гы
гы![]() ЗДгІЩњГЩЦеТГЪПРЖЪЙЪджНЯдРЖЩЋЁЃ
ЗДгІЩњГЩЦеТГЪПРЖЪЙЪджНЯдРЖЩЋЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгУЭМЫљЪОзАжУМьбщввЯЉЪБВЛашвЊГ§дгЕФЪЧ

ввЯЉЕФжЦБИ | ЪдМСX | ЪдМСY | |
A | CH3CH2BrгыNaOHввДМШмвКЙВШШ | H2O | KMnO4ЫсадШмвК |
B | CH3CH2BrгыNaOHввДМШмвКЙВШШ | H2O | Br2ЕФCCl4ШмвК |
C | CH3CH2OHгыХЈH2SO4ЙВШШжС170Ёц | NaOHШмвК | KMnO4ЫсадШмвК |
D | CH3CH2OHгыХЈH2SO4ЙВШШжС170Ёц | NaOHШмвК | Br2ЕФCCl4ШмвК |
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгЩгкFe(OH)2МЋвзБЛбѕЛЏЃЌЫљвдЪЕбщЪвКмФбгУбЧЬњбЮШмвКгыЩеМюЗДгІжЦЕУАзЩЋДПОЛЕФFe(OH)2ГСЕэЁЃШєгУШчЭМЫљЪОЪЕбщзАжУдђПЩжЦЕУДПОЛЕФFe(OH)2ГСЕэЃЌ СНМЋВФСЯЗжБ№ЮЊЪЏФЋКЭЬњЁЃ
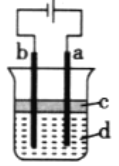
ЂйaЕчМЋВФСЯЮЊ_______ЃЌИУЕчМЋЕФЕчМЋЗДгІЪНЮЊ________.
ЂкШєАзЩЋГСЕэдкЕчМЋжмЮЇЩњГЩЃЌдђЕчНтвКdЪЧ____(ЬюађКХЃЌЯТЭЌ)ЃЛШєАзЩЋГСЕэдкСНМЋжЎМфЕФШмвКжаЩњГЩЃЌдђЕчНтвКdЪЧ____ЁЃ
A.ДПЫЎ B.NaClШмвК C.NaOHШмвКD.CuCl2ШмвК
ЂлвКЬхcЮЊБНЃЌЦфзїгУЪЧ__________
ЂмвЊЯыОЁдчдкСНМЋжЎМфЕФШмвКжаПДЕНАзЩЋГСЕэЃЌ ПЩвдВЩШЁЕФДыЪЉЪЧЃЈ_______ЃЉ
A.ИФгУЯЁСђЫсзїЕчНт B.ЪЪЕБдіДѓЕчдДЕчбЙ C.ЪЪЕБНЕЕЭЕчНтвКЮТЖШ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЬМЫсЖўМзѕЅ(DMCЃЉЪЧвЛжжЮоЖОЁЂЛЗБЃадФмгХвьЁЂгУЭОЙуЗКЕФЛЏЙЄдСЯЃЎдкДпЛЏМСзїгУЯТЃЌПЩгЩМзДМКЭCO2жБНгКЯГЩЬМЫсЖўМзѕЅЃКCO2+2CH3OHЁњCO(OCH3ЃЉ2 + H2O ЁЃФГбаОПаЁзщдкЦфЫћЬѕМўВЛБфЕФЧщПіЯТЃЌЭЈЙ§баОПДпЛЏМСгУСПЗжБ№ЖдзЊЛЏЪ§ЃЈTON ЃЉ ЕФгАЯьРДЦРМлДпЛЏМСЕФДпЛЏаЇЙћЃЎМЦЫуЙЋЪНЮЊTONЃНзЊЛЏЕФМзДМЕФЮяжЪЕФСПЃЏДпЛЏМСЕФЮяжЪЕФСПЃЎИљОнИУбаОПаЁзщЕФЪЕбщМАДпЛЏМСгУСПTONЕФгАЯьЭМЃЌХаЖЯЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ

AЃЎгЩМзДМКЭCO2жБНгКЯГЩЬМЫсЖўМзѕЅЃЌПЩвдРћгУМлСЎвзЕУЕФМзДМАбгАЯьЛЗОГЕФЮТЪвЦјЬхCO2зЊЛЏЮЊзЪдДЃЌдкзЪдДбЛЗРћгУКЭЛЗОГБЃЛЄЗНУцЖМОпгаживЊвтвх
BЃЎдкЗДгІЬхЯЕжаЬэМгКЯЪЪЕФЮќЫЎМСЃЌНЋЬсИпИУЗДгІЕФTON
CЃЎЕБДпЛЏМСгУСПЮЊ1.2ЁС10-5molЪБЃЌИУЗДгІЕФTON ДяЕНзюИпЕу
DЃЎЕБДпЛЏМСгУСПИпгк1.2ЁС10-5molЪБЃЌЫцзХДпЛЏМСгУСПЕФдіМгЃЌМзДМЕФЦНКтзЊЛЏТЪж№НЅНЕЕЭ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЪЕбщЪвЛиЪеЗЯЫЎжаБНЗгЕФЙ§ГЬШчЭМЫљЪОЁЃЯТСаЗжЮіДэЮѓЕФЪЧ

A.ВйзїЂёЮЊнЭШЁЁЂЗжвКЃЌнЭШЁМСвВПЩвдгУбЁгУ CCl4
B.БНЗгФЦЪЧРызгЛЏКЯЮяЃЌдкБНжаЕФШмНтЖШБШдкЫЎжаЕФаЁ
C.ЭЈЙ§ВйзїЂђЃЌБНПЩбЛЗЪЙгУЃЌШ§ВНВйзїОљашвЊЗжвКТЉЖЗ
D.БНЗгеДЕНЦЄЗєЩЯЃЌашгУ NaOH ШмвКЧхЯДКѓЃЌдйгУДѓСПЫЎВЛЖЯГхЯД
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПAlNаТаЭВФСЯгІгУЧАОАЙуЗКЃЌЦфжЦБИгыаджЪбаОПГЩЮЊШШЕуЁЃ
ЯрЙиЪ§ОнШчЯТЃК
ЮяжЪ | ШлЕу/Ёц | ЗаЕу/Ёц | гыN2ЗДгІЮТЖШ/Ёц | ЯргІЛЏКЯЮяЗжНтЮТЖШ/Ёц |
Al | 660 | 2467 | ЃО800 | AlNЃКЃО2000 ЃЈЃО1400Щ§ЛЊЃЉ AlCl3ЃКЃЈЃО181Щ§ЛЊЃЉ |
Mg | 649 | 1090 | ЃО300 | Mg3N2ЃКЃО800 |
(1)AlNЕФжЦБИЁЃ
Ђй ЛЏбЇЦјЯрГСЛ§ЗЈЁЃ
Ђё.вЛЖЈЮТЖШЯТЃЌвдAlCl3ЦјЬхКЭNH3ЮЊдСЯжЦБИAlNЃЌЗДгІЕФЛЏбЇЗНГЬЪНЪЧ____________________ЁЃ
Ђђ.ЩЯЪіЗДгІЪЪвЫЕФЮТЖШЗЖЮЇЪЧ______ЁцЃЈЬюзжФИЃЉЁЃ
a.75~100 b.600~1100 c.2000~2300
Ђк ТСЗлжБНгЕЊЛЏЗЈЁЃ
AlгыN2ПЩжБНгЛЏКЯЮЊAlNЙЬЬхЃЌAlNФмНЋAlАќЙќЃЌЗДгІФбвдМЬајНјааЁЃПижЦЮТЖШЃЌдкAlЗлжаОљдШВєШыЪЪСПMgЗлЃЌПЩЪЙAlМИКѕШЋВПзЊЛЏЮЊAlNЙЬЬхЁЃИУЙ§ГЬЗЂЩњЕФЗДгІгаЃК__________________ЁЂ_________КЭ2Al + N2 ![]() 2AlNЁЃ
2AlNЁЃ
ЂлЬМШШЛЙдЗЈЁЃ
вдAl2O3ЁЂCЃЈЪЏФЋЃЉКЭN2ЮЊдСЯЃЌдкИпЮТЯТжЦБИAlNЁЃ
вбжЊЃКЂЁ. 2Al2O3(s) 4Al(g) + 3O2(g) H 1 =ЃЋ3351 kJЁЄmol-1
ЂЂ. 2C(ЪЏФЋЃЌs) + O2(g) = 2CO(g) H 2 =Ѓ221 kJЁЄmol-1
ЂЃ. 2Al(g) + N2(g) = 2AlN(s) H 3 =Ѓ318 kJЁЄmol-1
дЫгУЦНКтвЦЖЏдРэЗжЮіЗДгІЂЂЖдЗДгІЂЁЕФПЩФмгАЯьЃК______________________________________ЁЃ
(2)AlNЕФаджЪЁЃAlNЗлФЉПЩЗЂЩњЫЎНтЁЃЯрЭЌЬѕМўЯТЃЌВЛЭЌСЃОЖЕФAlNЗлФЉЫЎНтЪБШмвКpHЕФБфЛЏШчЭМЫљЪОЁЃ
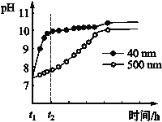
Ђй AlNЗлФЉЫЎНтЕФЛЏбЇЗНГЬЪНЪЧ____________________________________ЁЃ
Ђк НтЪЭt1-t2ЪБМфФкСНЬѕЧњЯпВювьЕФПЩФмдвђЃК_______________________________ЁЃ
(3)AlNКЌСПМьВтЁЃЯђa g AlNбљЦЗжаМгШызуСПХЈNaOHШмвКЃЌШЛКѓЭЈШыЫЎеєЦјНЋNH3ШЋВПеєГіЃЌНЋNH3гУЙ§СПЕФv1 mL c1 molЁЄL-1 H2SO4ШмвКЮќЪеЭъШЋЃЌЪЃгрЕФH2SO4гУv2 mL c2 molЁЄL-1 NaOHШмвКЧЁКУжаКЭЃЌдђбљЦЗжаAlNЕФжЪСПЗжЪ§ЪЧ________________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТЭМЫљЪОЮЊЙЄвЕКЯГЩАБЕФСїГЬЭМЁЃгаЙиЫЕЗЈДэЮѓЕФЪЧ

A. ВНжшЂйжаЁАОЛЛЏЁБПЩвдЗРжЙДпЛЏМСжаЖО
B. ВНжшЂкжаЁАМгбЙЁБМШПЩвдЬсИпдСЯЕФзЊЛЏТЪЃЌгжПЩвдМгПьЗДгІЫйТЪ
C. ВНжшЂлЁЂЂмЁЂЂнОљгаРћгкЬсИпдСЯЕФзЊЛЏТЪ
D. ВњЦЗвКАБГ§ПЩЩњВњЛЏЗЪЭтЃЌЛЙПЩгУзїжЦРфМС
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЫЕЗЈе§ШЗЕФЪЧ( )
A.АДЯЕЭГУќУћЗЈЃЌ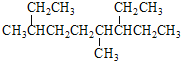 ЕФУћГЦЮЊ3ЃЌ6-ЖўМзЛљ-7-ввЛљШЩЭщ
ЕФУћГЦЮЊ3ЃЌ6-ЖўМзЛљ-7-ввЛљШЩЭщ
B.![]() ЗжзгжаЫљгадзгЙВЦНУц
ЗжзгжаЫљгадзгЙВЦНУц
C.БъзМзДПіЯТЃЌ1LаСЭщЭъШЋШМЩеЩњГЩCO2 8L
D.1.0mol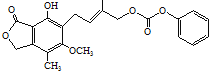 зюЖрФмгы5.0molNaOHЫЎШмвКЭъШЋЗДгІ
зюЖрФмгы5.0molNaOHЫЎШмвКЭъШЋЗДгІ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПШчЭМжаЕФЂёЪЧФГПЙжзСівЉЮяЕФжаМфЬхЃЌBЕФКЫДХЙВеёЧтЦзга3зщЗхЃЌCЕФЗжзгЪНЮЊC7H8OЃЌDЗжзгжагаСНИіЯрЭЌЧвДІгкЯрСкЮЛжУЕФКЌбѕЙйФмЭХЃЌEЕФЯрЖдЗжзгжЪСПБШDДѓ34.5ЁЃ
вбжЊЃКRCHO+R1CH2CHO![]() RCH=C(R1)CHO+H2OЁЃ
RCH=C(R1)CHO+H2OЁЃ
ЧыЛиД№ЯТСаЮЪЬтЃК
(1)CЕФУћГЦЪЧ______ЃЌBЕФНсЙЙМђЪНЮЊ_________ЃЌDзЊЛЏЮЊEЕФЗДгІРраЭЪЧ____________ЁЃ
(2)IжаЙйФмЭХЕФУћГЦЮЊ______ЃЌIЕФЗжзгЪНЮЊ________ЁЃ
(3)аДГіEзЊЛЏЮЊFЕФЛЏбЇЗНГЬЪН____________ЁЃ
(4)XЪЧGЫсЛЏКѓЕФВњЮяЃЌXгаЖржжЗМЯузхЭЌЗжвьЙЙЬхЃЌЗћКЯЯТСаЬѕМўЧвФмЗЂЩњвјОЕЗДгІЕФЭЌЗжвьЙЙЬхга____жжЃЈВЛАќРЈXЃЉЃЌаДГіКЫДХЙВеёЧтЦзга4зщЗхЕФЮяжЪЕФНсЙЙМђЪН____________ЁЃ
ЂйгіFeCl3ШмвКЗЂЩњЯдЩЋЗДгІЁЁЁЁЁЁЁЁЂкБНЛЗЩЯгаСНжжРраЭЕФШЁДњЛљ
(5)ВЮееЩЯЪіСїГЬЃЌвдввДМЮЊдСЯЃЈЦфЫћЮоЛњЪдМСздбЁЃЉПЩжЦШЁ2ЉЖЁЯЉЫсЃЌаДГіЯргІЕФКЯГЩТЗЯп__________________ЁЃ
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com