
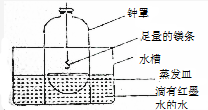
 某校研究性学习小组的同学对金属镁在空气中燃烧的产物进行探究.
某校研究性学习小组的同学对金属镁在空气中燃烧的产物进行探究.分析 (1)镁在空气中燃烧的产物生成氧化镁,根据元素守恒书写化学方程式;
(2)镁条在空气中燃烧,消耗了氧气和氮气,生成固体物质,根据装置图可知,液面会上升,根据液面上升的高度可判断容器中进行的反应;
(3)由镁在空气反应生成的淡黄色固体,根据元素守恒可知,该固体中应为氮化镁,是由氮气与镁反应生成的,氮化镁与水反应生成白色的氢氧化镁和有刺激性气味的氨气;
解答 解:(1)镁在空气中燃烧的产物生成氧化镁,反应的化学方程式为2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO,
故答案为:2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO;
(2)镁条在空气中燃烧,消耗了氧气和氮气,生成固体物质,根据装置图可知,液面会上升,如果钟罩中的水面上升大大超过钟罩容积的1/5,说明镁和氮气发生了反应,因为空气中O2的体积分数约为1/5,CO2的体积分数很小,只有和N2反应,钟罩中的水面上升才能大大超过钟罩容积的1/5,
故答案为:钟罩中的水面上升大大超过钟罩容积的1/5;因为空气中O2的体积分数约为1/5,CO2的体积分数很小,只有和N2反应,钟罩中的水面上升才能大大超过钟罩容积的1/5;
(3)由镁在空气反应生成的淡黄色固体,根据元素守恒可知,该固体中应为氮化镁,是由氮气与镁反应生成的,反应方程式为,氮化镁与水反应生成白色的氢氧化镁和有刺激性气味的氨气,反应方程式为Mg3N2+6H2O=3Mg(OH)2+2NH3↑,
故答案为:Mg3N2+6H2O=3Mg(OH)2+2NH3↑;3Mg+N2$\frac{\underline{\;点燃\;}}{\;}$Mg3N2.
点评 本题主要考查了空气与镁反应的原理探究,通过对现象的分析推测反应的原理,利用基础知识结合实验现象分析问题,侧重考查学生对基础知识的灵活运用的能力,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 11.2 L N2含有的分子数为0.5NA | |
| B. | 在常温常压下,1 mol Ne含有的原子数为NA | |
| C. | 71 g Cl2所含分子数为2NA | |
| D. | 在同温同压下,相同体积的任何气体单质所含的原子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验目的 | 探究温度对双氧水分解反应的速率的影响 | ||
| 实验 | 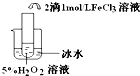 | 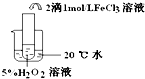 | 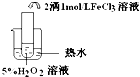 |
| 实验结论 | 结论:温度越高,反应速率越快 FeCl3在实验中的作用为:催化剂 | ||
| 反应方程式 | 2H2O2$\frac{\underline{\;FeCl_{3}\;}}{\;}$2H2O+O2↑ | ||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
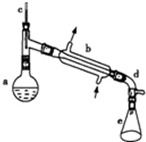 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应如下,
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应如下, $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ ,实验装置如图所示.可能用到的有关数据如表:
,实验装置如图所示.可能用到的有关数据如表:| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解性 | |
| 环乙醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I- | |
| B. | Ba(NO3)2可溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道 | |
| C. | 试管内壁残留的硫酸铁溶液与氢氧化钠溶液反应后产生红褐色固体,可以用盐酸将其溶解. | |
| D. | 某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用系统命名法命名:3,4-二甲基-3-乙基己烷
用系统命名法命名:3,4-二甲基-3-乙基己烷查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①、②、③ | B. | ①、③、④ | C. | ①、②、④ | D. | ②、③、④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 熵可以表示体系的混乱度,请你判断以下过程是熵增加过程还是熵减小过程:(填“熵增”或“熵减”)
熵可以表示体系的混乱度,请你判断以下过程是熵增加过程还是熵减小过程:(填“熵增”或“熵减”) 查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下浓硫酸能使铝发生钝化,可在常温下作用铝槽贮运浓硫酸 | |
| B. | 金属钠着火时,用细沙覆盖灭火 | |
| C. | 铝制容器不能盛装酸性溶液,可以盛装碱性溶液 | |
| D. | 碳酸氢钠是焙制糕点所用的发酵粉的主要成分之一 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com