
 用如图装置做如下实验.其中收集方法及所加试剂、现象、结论均正确的是( )
用如图装置做如下实验.其中收集方法及所加试剂、现象、结论均正确的是( )| 选项 | 气体 | 试剂 | 现象 | 结论 |
| A | NH3 | 酚酞溶液 | 溶液变红色 | NH3的水溶液呈碱性 |
| B | C12 | 紫色石蕊试液 | 溶液先变红后褪色 | Cl2有酸性和漂白性 |
| C | X | 澄清石灰水 | 溶液变浑浊 | X一定是CO2 |
| D | NO2 | KI-淀粉溶液 | 溶液变蓝色 | NO2有氧化性 |


科目:高中化学 来源: 题型:
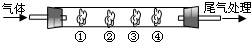
| B中棉花的位置 | ① | ② | ③ | ④ |
| 棉花浸取试剂 | 石蕊试液 | 品红溶液 | 淀粉和碘水混合液 | 氢硫酸 |
| 现象 | 变红 变红 |
褪色 褪色 |
褪色 | 浅黄色 |
| 体现SO2的性质 | 水溶液显酸性 | 漂白性 | 还原性 还原性 |
氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
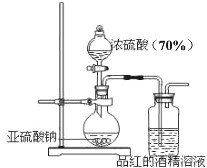 为了探究二氧化硫的漂白作用到底是二氧化硫本身还是二氧化硫与水作用的产物,某学习小组设计了如图装置来进行实验.请回答相关问题.
为了探究二氧化硫的漂白作用到底是二氧化硫本身还是二氧化硫与水作用的产物,某学习小组设计了如图装置来进行实验.请回答相关问题.| c(SO32-) | c(HSO3-) | c(H2SO3) | 褪色速度 | |
| Na2SO3溶液 | 大 | 小 | 小 | 快 |
| NaHSO3溶液 | 较上面 |
较上面 |
较上面 |
慢 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年河南省安阳一中高二下学期第一次阶段测试化学试卷(带解析) 题型:实验题
为探究苯与溴的取代反应,甲用如图装置Ⅰ进行如下实验:
将一定量的苯和溴放在烧瓶中,同时加入少量铁屑,3~5 min后发现装有AgNO3溶液的锥形瓶中有浅黄色的沉淀生成,即证明苯与溴发生了取代反应。
(1)装置I中①的化学方程式为
_______________________________________________________,
_______________________________________________________。
(2)①中长导管的作用是________________________________________________。
(3)烧瓶中生成的红褐色油状液滴的成分是__________________________,要想得到纯净的产物,可用____________试剂洗涤。洗涤后分离产品应使用的仪器是_______________。
(4)甲做实验时,乙观察到烧瓶中液体沸腾并有红棕色气体从导管中逸出,提出必须先除去红棕色气体,才能验证锥形瓶中的产物,原因是___________________________________。
(5)乙同学设计如图所示装置Ⅱ,并用下列某些试剂完成该实验。可选用的试剂是:苯;液溴;浓硫酸;氢氧化钠溶液;硝酸银溶液;四氯化碳。
a的作用是___________________________________
b中的试剂是_________________________________
比较两套装置,装置Ⅱ的主要优点是:(答出两点即可)
①____________________________________________
②____________________________________________
查看答案和解析>>
科目:高中化学 来源:2014届河南省高二下学期第一次阶段测试化学试卷(解析版) 题型:实验题
为探究苯与溴的取代反应,甲用如图装置Ⅰ进行如下实验:

将一定量的苯和溴放在烧瓶中,同时加入少量铁屑,3~5 min后发现装有AgNO3溶液的锥形瓶中有浅黄色的沉淀生成,即证明苯与溴发生了取代反应。
(1)装置I中①的化学方程式为
_______________________________________________________,
_______________________________________________________。
(2)①中长导管的作用是________________________________________________。
(3)烧瓶中生成的红褐色油状液滴的成分是__________________________,要想得到纯净的产物,可用____________试剂洗涤。洗涤后分离产品应使用的仪器是_______________。
(4)甲做实验时,乙观察到烧瓶中液体沸腾并有红棕色气体从导管中逸出,提出必须先除去红棕色气体,才能验证锥形瓶中的产物,原因是___________________________________。
(5)乙同学设计如图所示装置Ⅱ,并用下列某些试剂完成该实验。可选用的试剂是:苯;液溴;浓硫酸;氢氧化钠溶液;硝酸银溶液;四氯化碳。
a的作用是___________________________________
b中的试剂是_________________________________
比较两套装置,装置Ⅱ的主要优点是:(答出两点即可)
①____________________________________________
②____________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com