
一定条件下,有关金属腐蚀的下列说法不正确的是
A. 钢铁制品腐蚀时正极反应:O2+2H2O+4e-=4OH-
B. 在酸性较强的溶液中,金属主要发生析氢腐蚀
C. 为减缓金属腐蚀,可将要保护的金属物件与外电源的正极相连接
D. 在海轮外壳上附着一些锌块,则可以减缓海轮外壳的腐蚀
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
将某些化学知识用数轴表示,具有直观形象、简明易记的优点。下列用数轴表示的化学知识中不正确的是( )
A.分散系的分类: 
B.AlCl3和NaOH溶液反应后铝元素的存在形式: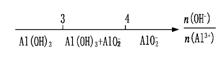
C.常温下甲基橙的变色范围: 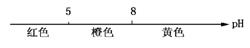
D.CO2与NaOH溶液反应的产物: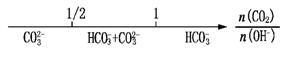
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸镍铵[(NH4) xNiy(SO4)m·nH2O]可用于电镀、印刷等领域。某同学为测定硫酸镍铵的组成,进行如下实验:
①准确称取2.335 0 g样品,配制成100.00 mL溶液A;
②准确量取25.00 mL溶液A,用0.040 00 mol·L-1的EDTA(Na2H2Y)标准溶液滴定其中的Ni2+(离子方程式为Ni2++H2Y2-===NiY2-+2H+),消耗EDTA标准溶液31.25 mL;
③另取25.00 mL溶液A,加足量NaOH溶液并充分加热,生成NH3 56.00 mL(标准状况)。
(1)若滴定管在使用前未用EDTA标准溶液润洗,测得的Ni2+含量将________(填“偏高”“偏低”或“不变”)。
(2)氨气常用 检验,现象是
(3)通过计算确定硫酸镍铵的化学式(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,正确的是 ( )
A.标准状况下,1mol任何物质的体积都约为22.4L
B.1mol任何气体所含分子数都相同,体积也都约为22.4L
C.常温常压下,金属Mg从盐酸中置换出1molH2时失去的电子数约为 1.204×1024
D.同温同压下,相同体积的任何气体单质所含原子数目相同
查看答案和解析>>
科目:高中化学 来源: 题型:
化学计量在化学中占有重要地位,请回答下列问题:
(1)0.3 mol NH3分子中所含原子数与 个H2O分子中所含原子数相等。
(2)含0.4 mol A13+的Al2(SO4)3中所含的SO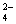 的物质的量是 _____ 。
的物质的量是 _____ 。
(3)已知16 g A和20 g B恰好完全反应生成0.04 mol C和31.76 g D,则C的摩尔质量为 ____________ 。
(4)在一定的温度和压强下,1体积气体X2跟3体积气体Y2化合生成2体积化合物,则该化合物的化学式是______________。
(5)某盐混合溶液中含有离子:Na+、Mg2+ 、Cl-、SO42-,测得Na+、Mg2+ 和Cl-的物质的量浓度依次为: 0.2 mol·L-1、0.25 mol·L-1、0.4 mol·L-1,则
c(SO42-)=___________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的
A.向硫酸铵溶液中加入氢氧化钡溶液:Ba2++SO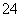 ===BaSO4↓
===BaSO4↓
B.双氧水中加入稀硫酸和KI溶液:H2O2+2H++2I-===I2+2H2O
C.用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑
D.Na2S2O3溶液中加入稀硫酸:2S2O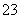 +4H+===SO
+4H+===SO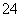 +3S↓+2H2O
+3S↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
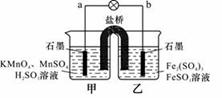
某合作学习小组的同学利用下列氧化还原反应设计原电池:
2KMnO4+10FeSO4+8H2SO4==2MnSO4+5Fe2(SO4)3+K2SO4+8H2O 盐桥中装有饱和K2SO4溶液,
下列叙述中正确的是
A.乙烧杯中发生还原反应
B.甲烧杯中溶液的pH逐渐减小
C.电池工作时,盐桥中的SO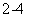 移向甲烧杯
移向甲烧杯
D.外电路的电流方向是从a到b
查看答案和解析>>
科目:高中化学 来源: 题型:
已知热化学方程式:
H2O(g)=H2(g) +  O2(g) △H = +241.8kJ/mol
O2(g) △H = +241.8kJ/mol
H2(g)+  O2(g) = H2O(1) △H = -285.8kJ/mol
O2(g) = H2O(1) △H = -285.8kJ/mol
当1g液态水变为水蒸气时,其热量变化是
A.吸热88kJ B. 吸热2.44KJ C.放热44kJ D. 吸热44KJ
查看答案和解析>>
科目:高中化学 来源: 题型:
有一未完成的离子方程式 +XO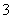 +6H+=3X2+3H2O,据此判断氧化产物和还原产物的物质的量之比为
+6H+=3X2+3H2O,据此判断氧化产物和还原产物的物质的量之比为
A.1:1 B.3:1 C.5:1 D.7:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com