
 .
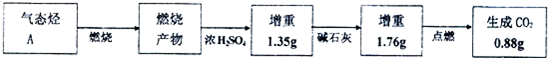
. 分析 (1)浓硫酸增重为生成水的质量,碱石灰增重为燃烧生成二氧化碳的质量,通过碱石灰后的气体燃烧又生成0.88g二氧化碳,说明烃燃烧时有CO生成,计算水的物质的量、二氧化碳总物质的量,根据原子守恒确定烃的实验式,烷烃分子中H原子数目达最大,烷烃通式为CnH2n+2,且烃分子中H原子为偶数,进而确定其分子式;
(2)①a的化学式为C6H12,与氢气加成生成2-甲基戊烷,则a为烯烃,2-甲基戊烷结构简式为(CH3)2CHCH2CH2CH3,利用还原碳碳双键方法确定a的可能数目,相连碳原子上均至少含有1个H原子可以形成碳碳双键;
②b能使溴水和酸性高锰酸钾褪色,含有碳碳双键,PMR谱中只有一个信号,分子中只有1种H原子,应含有4个甲基,分别连接碳碳双键上;
③c不能使酸性高锰酸钾溶液褪色,不能与溴水加成褪色,不含不饱和键,可萃取溴水中的溴,PMR谱中也只有一个信号,应为环己烷.
解答 解:(1)浓硫酸增重为生成水的质量,其物质的量为$\frac{1.35g}{18g/mol}$=0.075mol,故n(H)=0.15mol,碱石灰增重为燃烧生成二氧化碳的质量,通过碱石灰后的气体燃烧又生成0.88g二氧化碳,说明烃燃烧时有CO生成,二氧化碳总物质的量为$\frac{1.76g+0.88g}{44g/mol}$=0.06mol,即n(C)=0.06mol,则烃分子中N(C):N(H)=0.06:0.15=2:5,故该烃的实验式为C2H5,烷烃分子中H原子数目达最大,烷烃通式为CnH2n+2,令该烃分子式为C2aH5a,则5a≤4a+2,解得a≤2,由于烃分子中H原子为偶数,a只能取2,故该烃的分子式为:C4H10,
故答案为:C2H5;C4H10;
(2)①a的化学式为C6H12,与氢气加成生成2-甲基戊烷,则a为烯烃,2-甲基戊烷结构简式为(CH3)2CHCH2CH2CH3,相连碳原子上均至少含有1个H原子可以形成碳碳双键,故符合条件的a的有4种,
故答案为:4;
②b能使溴水和酸性高锰酸钾褪色,含有碳碳双键,PMR谱中只有一个信号,分子中只有1种H原子,应含有4个甲基,分别连接碳碳双键上,则b的结构简式为(CH3)2C=C(CH3)2,名称为:2,3-二甲基-2-丁烯,
故答案为:(CH3)2C=C(CH3)2;2,3-二甲基-2-丁烯;
③c不能使酸性高锰酸钾溶液褪色,不能与溴水加成褪色,不含不饱和键,可萃取溴水中的溴,PMR谱中也只有一个信号,c应为环己烷,结构简式为 ,
,
故答案为: .
.
点评 本题考查有机物分子式确定、限制条件同分异构体的书写等,(1)中注意利用烃的最简式、结合烷烃的通式判断分子式,难度中等.


科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的 |
| A | 向FeCl3溶液中滴加NaOH溶液 | 制备Fe(OH)3胶体 |
| B | 将CO2通入水玻璃溶液中 | 证明C元素的非金属性大于Si |
| C | 向苯和苯酚的混合溶液中加入足量的浓溴水,充分反应后过滤 | 除去苯中混有的苯酚 |
| D | 淀粉与稀H2SO4共热,再加入银氨溶液水浴加热 | 验证淀粉水解产物有无还原性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑥ | B. | ①③④⑤ | C. | ①④⑤⑥ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
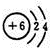 ,A与B在原子的电子层结构上的相同点是最外层均有4个电子.
,A与B在原子的电子层结构上的相同点是最外层均有4个电子.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷和乙醇 | B. | 乙烷和乙醇 | C. | 苯和苯甲酸 | D. | 乙炔和苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述四种氧化物中,至少有三种是碱性氧化物 | |
| B. | 将固体X加入氢氟酸中,X会溶解 | |
| C. | 滤液Y中的阳离子只有Mg2+、Al3+、Fe3+三种 | |
| D. | 滤液Y中加入过量氨水,所得沉淀为Fe(OH)3和Mg(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有④ | B. | 只有⑤ | C. | ①②③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
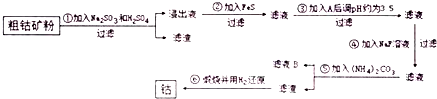
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸亚铁铵晶体要用冷水洗涤,而阿斯匹林过滤后则须用无水酒精洗涤 | |
| B. | 食醋总酸含量的测定实验中,若滴定终点没有控制好,即NaOH溶液滴加过量,则必须重做实验 | |
| C. | 火柴头中的氯元素检验的实验中,将火柴头(未燃烧)浸于水中,片刻后取少量溶液,加AgNO3溶液、稀硝酸,若出现白色沉淀,证明有氯元素 | |
| D. | 毒物误入口内,可将5~10mL稀硫酸铜溶液加入一杯温水中内服,人工促使呕吐出毒物后送医院 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com