
【题目】配制0.2 molL-1的碳酸钠溶液250 mL。
(1)根据计算需取___________克无水碳酸钠固体
(2)需要使用的主要仪器有托盘天平,____________、____________、_____________、____________和___________;
(3)下列操作对所配制溶液的浓度有何影响(填偏高、偏低或无影响)
①碳酸钠固体未充分干燥______________;
②容量瓶用碳酸钠溶液洗涤_____________;
③转移溶液时容量瓶中有少量的蒸馏水__________;
④定容时仰视读数_____________。
【答案】5.3 药匙 烧杯 玻璃棒 250 mL容量瓶 胶头滴管 偏低 偏高 无影响 偏低
【解析】
(1)根据n=c·V及m=n·M计算;
(2)根据配制物质的量浓度的溶液的步骤确定使用的仪器;
(3)结合c=![]() 分析实验误差。
分析实验误差。
(1)配制0.2 molL-1的碳酸钠溶液250 mL中溶质的物质的量n(Na2CO3)= c·V=0.2 mol/L×0.25 L=0.05 mol,则需碳酸钠的质量m(Na2CO3)= n·M=0.05 mol L×106 g/mol=5.3 g。
(2)配制一定条体积、一定物质的量浓度的溶液的步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀。称量固体质量要使用托盘天平、药匙,在烧杯中溶解固体药品,为促进物质溶解,要使用玻璃棒搅拌,待溶液冷却至室温后,用玻璃棒将溶液转移至已经查漏的250 mL的容量瓶中,并洗涤烧杯内壁和玻璃棒2-3次,洗涤液也转移至容量瓶中,然后向容量瓶中加水定容,至凹液面离刻度线1-2 cm时,改用胶头滴管滴加液体至凹液面最低处与刻度线相切,然后盖上瓶塞,上下颠倒,反复摇匀,得到的溶液就是0.2 molL-1的碳酸钠溶液250 mL碳酸钠溶液。可见在配制溶液过程中使用的仪器出来有托盘天平外,还有药匙、烧杯、玻璃棒、250mL容量瓶、胶头滴管。
(3)①碳酸钠固体未充分干燥,则溶质的物质的量n偏小,根据c=![]() 可知会导致配制溶液浓度偏低;
可知会导致配制溶液浓度偏低;
②容量瓶用碳酸钠溶液洗涤,会使溶质的物质的量偏多,最终使配制的溶液浓度偏高;
③转移溶液时容量瓶中有少量的蒸馏水,不影响溶质的物质的量及溶液的体积,因此对配制的溶液的浓度无影响;
④定容时仰视读数,会使溶液的体积偏大,根据c=![]() 可知溶液的体积偏大会导致配制溶液浓度偏低。
可知溶液的体积偏大会导致配制溶液浓度偏低。


科目:高中化学 来源: 题型:
【题目】下列反应中属于水解反应的是( )
A.CH2=CH2+H2O![]() CH3CH2OH
CH3CH2OH
B.2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
C.CH3CH2Br+NaOH![]() CH3CH2OH+NaBr
CH3CH2OH+NaBr
D.CH3COOH+C2H5OH![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向100mL饱和的H2S溶液中通入SO2气体(气体体积换算成标准状况),发生反应:2H2S+SO2=3S↓+2H2O,测得溶液pH与通入SO2的关系如图所示。下列有关说法错误的是( )
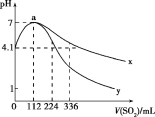
A.a点水的电离程度最大
B.该温度下H2S的Ka1≈10-7.2
C.曲线y代表继续通入SO2气体后溶液pH的变化
D.a点之后,随SO2气体的通入,![]() 的值始终减小
的值始终减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将足量Cl2缓缓通入含0.02mol H2SO3和0.02mol HBr的混合溶液中。在此过程中溶液的pH与Cl2用量的关系示意图是(溶液体积变化忽略不计,且不考虑Cl2与水反应)
A. 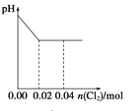 B.
B. 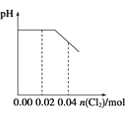 C.
C.  D.
D. 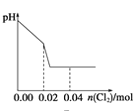
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化铬(CrO3)又叫铬酸酐,是一种暗红色固体,溶于水会生成铬酸(H2CrO4),200℃以上会部分分解生成氧化铬(Cr2O3)。
I.下图是用铬铁矿(主要成分是FeCr2O4,含A12O3、SiO2等杂质)生产CrO3的传统工艺流程,请回答相关问题。
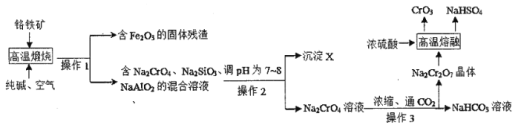
(1)操作1的名称是____,沉淀X的成分是_____(填化学式)。
(2)高温煅烧时FeCr2O4参与反应的化学方程式是____。
II.某工厂采用了一种新的生产CrO3的工艺流程,与传统工艺流程主要区别如下图所示(中间过程省略)。
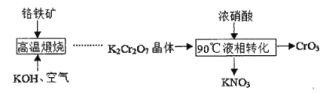
(3)液相转化过程发生反应的化学方程式是____。
(4)新工艺与传统工艺相比有多种优点:可得到价值更高的副产品KNO3;___;从绿色化学角度考虑新工艺也存在某种缺点,该缺点是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硫铁矿(主要成分为![]() ,还有少量
,还有少量![]() 、
、![]() 等杂质)为原料制备绿矾晶体
等杂质)为原料制备绿矾晶体![]() 的工艺流程如下:
的工艺流程如下:
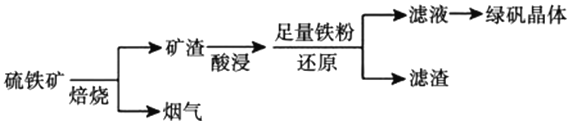
(1)“酸浸”过程,矿渣中的![]() 与稀
与稀![]() 反应的离子方程式____________________。
反应的离子方程式____________________。
(2)烟气中的![]() 会污染环境,可用足量氨水吸收。写出该反应的离子方程式____________________________。
会污染环境,可用足量氨水吸收。写出该反应的离子方程式____________________________。
(3)写出检验滤液中阴离子的方法___________________________。
(4)铁粉还原过滤,滤渣主要成分是___________________________(写化学式)。
(5)燃料细菌脱硫法是用氧化亚铁硫杄菌(T.f)对硫铁矿进行催化脱硫,同时得到![]() 溶液。其过程如图所示:
溶液。其过程如图所示:
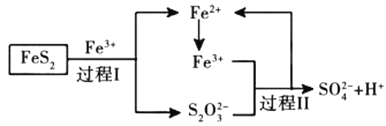
已知总反应为:![]()
写出过程Ⅱ反应的离子方程式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有室温下四种溶液,下列有关叙述不正确的是( )
序号 | ① | ② | ③ | ④ |
pH | 11 | 11 | 3 | 3 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A.③和④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B.②和③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C.分别加水稀释10倍,四种溶液的pH:①>②>④>③
D.V1L ④与V2L ①溶液混合后,若混合后溶液pH=7,则V1<V2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)Cr3+(aq)+3OH-(aq)。常温下,Cr(OH)3溶度积Ksp=1.0×10-32,要使c(Cr3+)完全沉淀,溶液的pH应调至______。
(2)25℃时,向水的电离平衡体系中加入少量碳酸钠固体,得到pH为11的溶液,其水解方程式为_________,由水电离出的c(OH-)=________mol·L-1。
(3)在100℃下,将pH=3的硫酸溶液和pH=10的NaOH溶液混合,若要使混合后溶液的pH=7,则硫酸溶液和NaOH溶液的体积比约为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为______,3d能级上的未成对电子数为______。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是____。
②在[Ni(NH3)6]SO4中Ni2+与NH3之间形成的化学键称为____,提供孤电子对的成键原子是______。
③氨的沸点__________(填“高于”或“低于”)膦(PH3),原因是_________;氨是______分子(填“极性”或“非极性”),中心原子的轨道杂化类型为_______。
(3)单质铜及镍都是由_______键形成的晶体;元素铜与镍的第二电离能分别为:ICu=1958 kJ·mol–1、INi=1 753 kJ·mol–1,ICu> INi的原因是_______________。
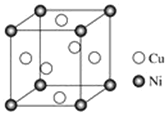
(4)某镍白铜合金的立方晶胞结构如图所示。
①晶胞中铜原子与镍原子的数量比为________。
②若合金的密度为d g·cm–3,晶胞参数a=______nm。(用含有d、NA的式子表示,可以不化简)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com