
| 4.66g |
| 233g/mol |
| 2.24L |
| 22.4L/mol |
| 1 |
| 3 |
| 45.3g-0.1mol×(27+18)g/mol-0.2mol×96g/mol |
| 18g/mol |
| 45.3g |
| 453g/mol |
| 2 |
| 3 |
| 1 |
| 2 |
| 2 |
| 3 |


 应用题作业本系列答案
应用题作业本系列答案 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、Al2O3
| |||||
B、S
| |||||
C、Fe2O3
| |||||
D、MgCl2(aq)
|
查看答案和解析>>
科目:高中化学 来源: 题型:
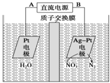
| A、电源正极为B |
| B、阳极反应式为2NO3-+6H2O+10e-=N2↑+12OH- |
| C、当产生N211.2L时,电路中通过的电子数为5NA |
| D、若电解过程中转移了2 mol电子,则两极产生的气体的质量差为10.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某校化学小组的同学开展测定Na2SO3和NaCl的固体混合物中Na2SO3质量分数的探究实验,他们提出下列实验方案:
某校化学小组的同学开展测定Na2SO3和NaCl的固体混合物中Na2SO3质量分数的探究实验,他们提出下列实验方案:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只存在于O2中 |
| B、只存于SO3中 |
| C、同时存在于O2和SO3中 |
| D、同时存在于O2、SO2和SO3中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化铝常用于制造耐火材料 |
| B、浓硫酸用于干燥氨气 |
| C、生产水泥的主要原料是黏土、纯碱 |
| D、Na2O用作呼吸面具的供氧剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ”标志垃圾筒的是
”标志垃圾筒的是查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com