
| A. | 硫原子的原子结构示意图: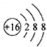 | |
| B. | NH4Cl的电子式: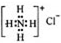 | |
| C. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O | |
| D. | 用电子式表示氯化氢分子的形成过程: |
分析 A、硫原子的核外有16个电子;
B、氯离子为阴离子,应标出最外层电子;
C、质量数=质子数+中子数;
D、HCl为共价化合物.
解答 解:A、硫原子的核外有16个电子,故硫原子的结构示意图为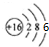 ,故A错误;
,故A错误;
B、氯离子为阴离子,应标出最外层电子,故氯化铵的电子式为 ,故B错误;
,故B错误;
C、质量数=质子数+中子数,由于氧原子的质子数为8,故中子数为10的氧原子为:${\;}_{8}^{18}$O,故C正确;
D、氯化氢是共价化合物,不存在离子键,氢原子与氯原子之间形成1对共用电子对,氯原子最外层有7个电子,氯化氢分子的形成过程: ,故D错误;
,故D错误;
故选C.
点评 本题考查常见化学用语的书写,题目难度不大,本题注意相关基础知识的积累,注意把握在书写电子式之前,先判断化合物是离子化合物还是共价化合物.


科目:高中化学 来源: 题型:解答题
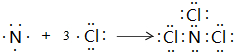 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第ⅠA 族元素单质的熔点随着原子序数递增而升高 | |
| B. | 卤族元素单质的熔点随着原子序数递增而升高 | |
| C. | 第ⅤA族元素的气态氢化物沸点随着原子序数递增而升高 | |
| D. | 第三周期元素形成的简单离子半径随着原子序数递增而增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、M两种元素形成的化合物中只能存在离子键 | |
| B. | 元素Z的某种氧化物具有漂白性,是因为这种氧化物具有强氧化性 | |
| C. | 由于W、Z、M元素的氢化物相对分子质量依次减小,所以其沸点依次降低 | |
| D. | 元素W和M的某些单质可作为水处理中的消毒剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ⑤⑥ | C. | ③⑥ | D. | ①⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第七周期0族 | B. | 第六周期第IA族 | C. | 第八周期第ⅡA族 | D. | 第七周期第ⅦA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
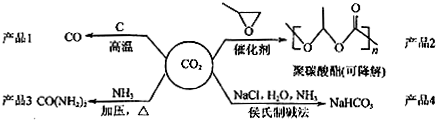
| A. | 反应CO2(g)+C(s)═2CO(g) 的△H>0,△S>0 | |
| B. | 用聚碳酸酯代替聚乙烯等传统塑料,可消除被色污染 | |
| C. | CO(NH2)2与NH4CNO互为同分异构体,两者化学性质相同 | |
| D. | 侯氏制碱法的工艺过程中应用了物质溶解度的差异 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
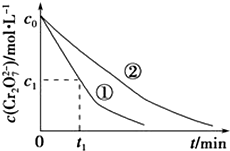 某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:| 实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
| ① | 4 | 60 | 10 | 30 |
| ② | 5 | 60 | 10 | 30 |
| ③ | 5 | 60 |
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
| 用等物质的量K2SO4•Al2(SO4)3•24H2O代替实验①中的铁明矾,控制其他反应条件与实验①相同,进行对比实验 | 反应进行相同时间后,若溶液中c(Cr2O72-)大于实验①中c(Cr2O72-),则假设一成立;若两溶液中的c(Cr2O72-)相同,则假设一不成立 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com