
| n£ØSO32-£©£ŗn£ØHSO3-£© | 91£ŗ9 | 1£ŗ1 | 9£ŗ91 |
| pH | 8.2 | 7.2 | 6.2 |
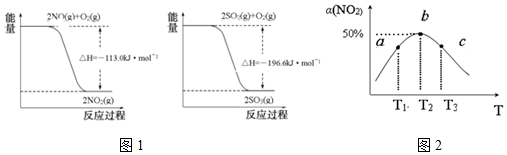
·ÖĪö £Ø1£©ŅŃÖŖÓÉĶ¼·ÖĪöµĆ¢Ł2SO2£Øg£©+O2£Øg£©ØT2SO3£Øg£©£»”÷H=-196.6kJ/mol
¢ŚO2£Øg£©+2NO£Øg£©ØT2NO2£Øg£©£»”÷H=-113.0kJ/mol
øł¾ŻøĒĖ¹¶ØĀÉ$\frac{¢Ł-¢Ś}{2}$æÉµĆ£ŗSO2£Øg£©+NO2£Øg£©=SO3£Øg£©+NO£Øg£©”÷H=-41.8kJ/mol£¬
£Ø2£©¢ŁĪĀ¶ČŌ½øß»Æѧ·“Ó¦ĖŁĀŹŌ½æģ£»
¢Śn±ä£ØNO2£©=0.1mol”Į50%=0.05mol
SO2+NO2=SO3+NO
æŖŹ¼£Øn£© 0.15 0.1 0 0
±ä 0.05 0.05 0.05 0.05
2min 0.1 0.05 0.05 0.05£¬¾Żv£ØSO3£©=$\frac{”÷n£ØS{O}_{3}£©}{”÷t}$£»K=$\frac{c£ØS{O}_{3}£©c£ØNO£©}{c£ØS{O}_{2}£©c£ØN{O}_{2}£©}$£»ĪĀ¶Č²»±äK²»±ä£¬Ēów£ØNO2£©£¬¾Ż“Ė½ųŠŠ·ÖĪö£»
¢Ū¾ŻÓ°ĻģĘ½ŗāŅĘ¶ÆµÄŅņĖŲ·ÖĪö£»
£Ø3£©¢ŁĪüŹÕŅŗ³ŹÖŠŠŌŹ±£¬ČÜÖŹĪŖŃĒĮņĖįÄĘŗĶŃĒĮņĖįĒāÄĘ£¬µēĄėÓėĖ®½āµÄ³Ģ¶ČĻąµČ£¬½įŗĻµēŗÉŹŲŗć½ā“š£»
¢Ś¾ŻŅõ¼«µĆµē×Ó·¢Éś»¹Ō·“Ó¦·ÖĪö£®
½ā“š ½ā£ŗ£Ø1£©ŅŃÖŖÓÉĶ¼·ÖĪöµĆ¢Ł2SO2£Øg£©+O2£Øg£©ØT2SO3£Øg£©£»”÷H=-196.6kJ/mol
¢ŚO2£Øg£©+2NO£Øg£©ØT2NO2£Øg£©£»”÷H=-113.0kJ/mol
øł¾ŻøĒĖ¹¶ØĀÉ$\frac{¢Ł-¢Ś}{2}$æÉµĆ£ŗSO2£Øg£©+NO2£Øg£©=SO3£Øg£©+NO£Øg£©”÷H=-41.8kJ/mol£¬
¹Ź“š°øĪŖ£ŗSO2£Øg£©+NO2£Øg£©=SO3£Øg£©+NO£Øg£©”÷H=-41.8kJ/mol£»
£Ø2£©¢ŁĪĀ¶ČŌ½øß»Æѧ·“Ó¦ĖŁĀŹŌ½æģ£¬¹Ź¦Ō£Øa£©£¼¦Ō£Øc£©£¬¹Ź“š°øĪŖ£ŗ£¼£»
¢Śn±ä£ØNO2£©=0.1mol”Į50%=0.05mol
SO2+NO2=SO3+NO
æŖŹ¼£ØC£© 0.15 0.1 0 0
±ä 0.05 0.05 0.05 0.05
2min 0.1 0.05 0.05 0.05£¬
v£ØSO3£©=$\frac{”÷n£ØS{O}_{3}£©}{”÷t}$=$\frac{0.05mol/L}{2min}$=0.025mol•L-1•min-1£»k=$\frac{c£ØS{O}_{3}£©c£ØNO£©}{c£ØS{O}_{2}£©c£ØN{O}_{2}£©}$=$\frac{0.05”Į0.05}{0.1”Į0.05}$=0.5£»w£ØNO2£©=$\frac{0.05}{0.1}”Į100%$=50%£¬
SO2+NO2=SO3+NO
æŖŹ¼£ØC£© 0.4 0.25 0.05 0.05
±ä x x x x
2min 0.4-x 0.25-x 0.05+x 0.05+x£¬
ŅņĪŖĪĀ¶Č²»±ä£¬¹ŹK²»±ä£¬¼“$\frac{£Ø0.05+x£©£Ø0.05+x£©}{£Ø0.4-x£©£Ø0.25-x£©}$=0.5£¬½āµĆx=0.125£¬¹Źw£ØNO2£©=$\frac{0.125}{0.25}”Į100%$=50%£¬¹Ź×Ŗ»ÆĀŹ²»±ä£»
¹Ź“š°øĪŖ£ŗ0.025mol•L-1•min-1£»0.5£»²»±ä£»
¢ŪNO2µÄ×Ŗ»ÆĀŹĖęĪĀ¶ČÉżøßĻČŌö“óŗó¼õŠ”µÄŌŅņŹĒ£¬ĪĀ¶ČĪŖT2£¬bµćĪŖĘ½ŗāµć£¬T2ŅŌĒ°ĪĀ¶ČÉżøߣ¬·“Ó¦ĖŁĀŹ¼Óæģ£¬NO2×Ŗ»ÆĀŹŌö“ó£¬T2ŅŌŗó£¬øĆ·“Ó¦ĪŖ·ÅČČ·“Ó¦£¬ÉżøßĪĀ¶Č£¬Ę½ŗāĻņÄę·“Ó¦·½ĻņŅĘ¶Æ£¬×Ŗ»ÆĀŹ¼õŠ”£¬
¹Ź“š°øĪŖ£ŗĪĀ¶ČĪŖT2£¬bµćĪŖĘ½ŗāµć£¬T2ŅŌĒ°ĪĀ¶ČÉżøߣ¬·“Ó¦ĖŁĀŹ¼Óæģ£¬NO2×Ŗ»ÆĀŹŌö“ó£¬T2ŅŌŗó£¬øĆ·“Ó¦ĪŖ·ÅČČ·“Ó¦£¬ÉżøßĪĀ¶Č£¬Ę½ŗāĻņÄę·“Ó¦·½ĻņŅĘ¶Æ£¬×Ŗ»ÆĀŹ¼õŠ”£»
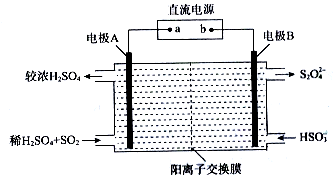
£Ø3£©¢ŁSO32-+H2O?HSO3-+OH-£¬HSO3-?H++SO32-£¬ŃĒĮņĖįĮ½²½Ė®½ā£¬µŚŅ»²½Ė®½āŌ¶Ō¶“óÓŚµŚ¶ž²½Ė®½ā£¬ŌņĄė×ÓÅضČĪŖc£ØNa+£©£¾c£ØHSO3-£©£¾c£ØSO32-£©£¾c£ØH+£©=c£ØOH-£©£¬
¹Ź“š°øĪŖ£ŗc£ØNa+£©£¾c£ØHSO3-£©£¾c£ØSO32-£©£¾c£ØH+£©=c£ØOH-£©£»
¢Ś¾ŻŅõ¼«µĆµē×Ó·¢Éś»¹Ō·“Ó¦£¬¹Źµē¼«·½³ĢŹ½ĪŖ2HSO3-+2H++2e-=S2O42-+2H2O£¬
¹Ź“š°øĪŖ£ŗ2HSO3-+2H++2e-=S2O42-+2H2O£®
µćĘĄ ±¾Ģāæ¼²éĮĖ»ÆŃ§Ę½ŗā³£ŹżµÄ¼ĘĖć£¬ČČ»Æѧ·½³ĢŹ½µÄŹéŠ“£¬µē½ā³ŲŌĄķ£¬ĢāÄæ×ŪŗĻŠŌ½ĻĒ棬ÄŃ¶Č½Ļ“ó£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | OH- | B£® | NO3- | C£® | CO32- | D£® | Ag + |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
| A£® | 1±ź×¼“óĘųŃ¹ĻĀŌ×ÓŹżĪŖNAµÄĖ®ÕōĘųĪŖ1mol | |
| B£® | 1L1mol/LµÄNaOHČÜŅŗÖŠNa+µÄĪļÖŹµÄĮæĪŖ1mol | |
| C£® | ±ź×¼×“æöĻĀ£¬22.4Lŗ¤ĘųµÄÖŹĮæĪŖ4g | |
| D£® | ÓĆŗ¬1molHClµÄŃĪĖįÖĘČ”ĀČĘų£¬ĀČŌŖĖŲŹ§Č„µÄµē×ÓŹżĪŖ4NA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
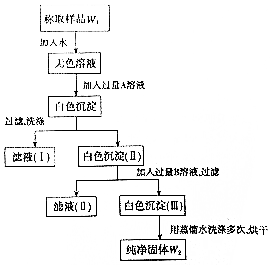 ŹµŃéŹŅÓŠŅ»ĘæŅŃ²æ·Ö±»Ńõ»ÆµÄŃĒĮņĖįÄĘ¹ĢĢ壬ĪŖ²ā¶ØŃĒĮņĖįÄʵÄÖŹĮæ·ÖŹż£¬Ä³Ķ¬Ń§Éč¼ĘČēĶ¼ĖłŹ¾ŹµŃ飮Ēėøł¾ŻŹµŃé²½ÖčĢīŠ“ĻĀĮŠæÕ°×£®
ŹµŃéŹŅÓŠŅ»ĘæŅŃ²æ·Ö±»Ńõ»ÆµÄŃĒĮņĖįÄĘ¹ĢĢ壬ĪŖ²ā¶ØŃĒĮņĖįÄʵÄÖŹĮæ·ÖŹż£¬Ä³Ķ¬Ń§Éč¼ĘČēĶ¼ĖłŹ¾ŹµŃ飮Ēėøł¾ŻŹµŃé²½ÖčĢīŠ“ĻĀĮŠæÕ°×£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
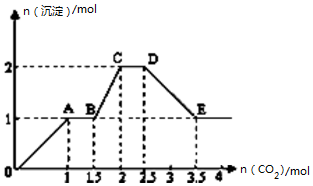 ĻÖÓŠŅ×ČÜĒæµē½āÖŹµÄ»ģŗĻČÜŅŗ10L£¬ĘäÖŠæÉÄÜŗ¬“ęK+”¢Ba2+”¢Na+”¢NH4+”¢Cl-”¢SO42-”¢AlO2-”¢OH-ÖŠµÄ¼øÖÖ£¬ĻņĘäÖŠĶØČėCO2ĘųĢ壬²śÉś³ĮµķµÄĮæÓėĶØČėCO2µÄĮæÖ®¼äµÄ¹ŲĻµČēĶ¼ĖłŹ¾£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©
ĻÖÓŠŅ×ČÜĒæµē½āÖŹµÄ»ģŗĻČÜŅŗ10L£¬ĘäÖŠæÉÄÜŗ¬“ęK+”¢Ba2+”¢Na+”¢NH4+”¢Cl-”¢SO42-”¢AlO2-”¢OH-ÖŠµÄ¼øÖÖ£¬ĻņĘäÖŠĶØČėCO2ĘųĢ壬²śÉś³ĮµķµÄĮæÓėĶØČėCO2µÄĮæÖ®¼äµÄ¹ŲĻµČēĶ¼ĖłŹ¾£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©| A£® | øĆČÜŅŗÖŠÄÜČ·¶Ø“ęŌŚµÄĄė×ÓŹĒ Ba2+”¢AlO2-”¢NH4+ | |
| B£® | æĻ¶Ø²»“ęŌŚµÄĄė×ÓŹĒSO42-”¢OH- | |
| C£® | Čō²»ÄÜČ·¶ØµÄĄė×ÓÖŠÖĮÉŁ»¹“ęŌŚŅ»ÖÖŃōĄė×Ó£¬ŌņøĆĄė×ÓµÄ×īŠ”ÅضČĪŖ0.2mol/L | |
| D£® | OA ¶Ī·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗ2 AlO2-+CO2+3H2O=2Al£ØOH£©3”ż+CO32- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŌŚ³£ĪĀ³£Ń¹ĻĀĪŖĘųĢå | B£® | ²»ÄÜ·¢ÉśŃõ»Æ·“Ó¦ | ||
| C£® | ²»ÄÜ×ŌÉķ¼Ó³ÉŠĪ³É¾ŪĀČŅŅĻ© | D£® | ÄÜŹ¹äåµÄCCl4ČÜŅŗĶŹÉ« |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĄūÓĆ½šŹōÄĘ | B£® | ĄūÓĆÖŹĘ×·Ø | ||
| C£® | ĄūÓĆŗģĶā¹āĘ×·Ø | D£® | ĄūÓĆŗĖ“Ź²ÕńĒāĘ× |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com