
下列说法不正确的是( )
|
| A. | 金属汞洒落,必须尽可能收集起来,并将硫磺粉撒在洒落的地方,使金属汞转变成不挥发的硫化汞 |
|
| B. | 滴定管在使用前要用待装液润洗,而容量瓶不用润洗 |
|
| C. | AlCl3溶液蒸干、灼烧至恒重,最终剩余固体是AlCl3 |
|
| D. | 碘单质与食盐的分离常用升华法,而碘水中提取碘单质则常用萃取法 |
| 过滤、分离与注入溶液的仪器;盐类水解的应用;物质的分离、提纯和除杂. | |
| 专题: | 实验评价题. |
| 分析: | A.汞是银白色的金属,熔点﹣38.87℃,沸点356.6℃,汞洒落到地上,人会因为吸入汞的蒸汽而中毒,汞易与硫单质化合并生成稳定化合物硫化汞(HgS)固体; B.滴定管使用前要润洗,否则应仪器壁上有水,相当于稀释待量物质,容量瓶用来配制一定浓度溶液,不用润洗; C.AlCl3溶液在加热时水解生成Al(OH)3; D.根据碘单质性质选取分离方法. |
| 解答: | 解:A.汞挥发的蒸气有毒性,当汞洒落在地面时,由于硫单质能够与汞反应,可以在其洒落的地面上洒上硫粉已便除去汞,故A正确; B.滴定管使用前要润洗,否则应仪器壁上有水,相当于稀释待量物质,容量瓶用来配制一定浓度溶液,若用待测液润洗,造成溶质损失,故B正确; C.AlCl3溶液在加热时水解生成Al(OH)3,生成的HCl易挥发,最终生成Al(OH)3,在加强热时,Al(OH)3不稳定,分解生成Al2O3,故C错误; D.碘易升华,故碘单质与食盐的分离常用升华法,碘易溶于有机溶剂,故可用四氯化碳来萃取碘单质,故D正确. 故选C. |
| 点评: | 本题考查了实验安全和基本操作,题目难度不大,注意汞和碘的特殊性质. |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
两种气态烃以一定比例混合,在105℃时1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10L.下列各组混合烃中不符合此条件的是( )
|
| A. | CH4 C2H4 | B. | CH4 C3H6 | C. | C2H4 C3H4 | D. | C2H2 C3H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是铅蓄电池充、放电时的工作示意图,已知放电时电池反应为PbO2+Pb+
4H++2S ====2PbSO4+2H2O。下列有关说法正确的是 ( )
====2PbSO4+2H2O。下列有关说法正确的是 ( )

A.K与N相接时,能量由电能转化为化学能
B.K与N相接时,H+向负极区迁移
C.K与M相接时,所用电源的a极为负极
D.K与M相接时,阳极附近的pH逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
在硫酸铝、硫酸钾和明矾[KAl(SO4)2•12H2O]的混合溶液中,SO42﹣的浓度为0.4mol/L,当加入等体积0.4mol/L KOH溶液时,生成的沉淀恰好完全溶解.则反应后溶液中K+的浓度约为( )
|
| A. | 0.225mol/L | B. | 0.25mol/L | C. | 0.45mol/L | D. | 0.9mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
用CO和H2合成CH3OH的化学方程式为CO(g)+2H2(g)═CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是( )
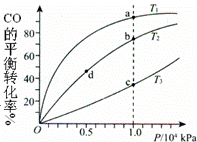
|
| A. | 温度:T1>T2>T3 |
|
| B. | 正反应速率:υ(a)>υ(c) υ(b)>υ(d) |
|
| C. | 平衡常数:K(a)>K(c) K(b)=K(d) |
|
| D. | 平均摩尔质量:M(a)<M(c) M(b)<M(d) |
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与环境、生活、材料密切相关。下列说法正确的是( )
A.安装煤炭燃烧过程的“固硫”装置,主要是为了提高煤的利用率
B.二氧化氯和三氯化铁都常用于自来水的处理,二者的作用原理是相同的
C.通过有机合成,可以制造出比钢铁更强韧的新型材料
D.气溶胶和液溶胶的差别在于分散质的物质状态
查看答案和解析>>
科目:高中化学 来源: 题型:
已知Fe3+和I-在水溶液中的反应如下:2I-+2Fe3+====I2+2Fe2+。某温度下该反应的正反应速率和I-、Fe3+浓度的关系为v=kcm(I-)·
cn(Fe3+)(k为常数)。
|
| c(I-)/mol·L-1 | c(Fe3+)/mol·L-1 | v/mol·L-1·s-1 |
| ① | 0.20 | 0.80 | 0.032 k |
| ② | 0.60 | 0.40 | 0.144 k |
| ③ | 0.80 | 0.20 | 0.128 k |
由此推知,有关Fe3+、I-的浓度对反应速率影响的判断正确的是( )
A.Fe3+浓度对正反应速率影响程度大于I-浓度的影响程度
B.Fe3+浓度对正反应速率影响程度小于I-浓度的影响程度
C.Fe3+浓度对正反应速率影响程度等于I-浓度的影响程度
D.无法比较
查看答案和解析>>
科目:高中化学 来源: 题型:
把煤作为燃料可通过下列两种途径:
途径Ⅰ C(s)+O2(g)====CO2(g) ΔH1<0
途径Ⅱ 先制水煤气:
C(s)+H2O(g)====CO(g)+H2(g) ΔH2>0
再燃烧水煤气:
2CO(g)+O2(g)====2CO2(g) ΔH3<0
2H2(g)+O2(g)====2H2O(g) ΔH4<0
请回答下列问题:
(1)判断两种途径放热:途径Ⅰ放出的热量______途径Ⅱ放出的热量(填“大于”“等于”或“小于”)。
(2)ΔH1、ΔH2、ΔH3、ΔH4的数学关系是________________________。
(3)由于制取水煤气的反应里,反应物具有的总能量_______(填“大于”“等于”或“小于”)生成物具有的总能量,那么在化学反应时,反应物就需要_______能量才能转化为生成物,因此其反应条件为_________________。
(4)已知:Fe2O3(s)+3CO(g)====2Fe(s)+3CO2(g)
ΔH1=-25 kJ·mol-1①
3Fe2O3(s)+CO(g)====2Fe3O4(s)+CO2(g)
ΔH2=-47 kJ·mol-1②
Fe3O4(s)+CO(g)====3FeO(s)+CO2(g)
ΔH3=+19 kJ·mol-1③
请写出CO还原FeO的热化学方程式:_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com