
| A、用元素分析仪确定物质中是否含有C、H、O、N、S、Cl、Br等元素 |
| B、焰色反应能用来鉴别所有金属元素 |
| C、用原子吸收光谱确定物质中含有哪些金属元素 |
| D、层析法利用了混合物中各物质被吸附性能的不同 |


科目:高中化学 来源: 题型:
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 铁是地壳中含量最高的金属元素 | 铁是人类最早使用的金属材料 | Ⅰ对;Ⅱ对;有 |
| B | 常温下铁与稀硫酸反应生成氢气 | 高温下氢气能还原氧化铁得到铁 | Ⅰ对;Ⅱ对;无 |
| C | 铁属于过渡元素 | 铁和铁的某些化合物可用做催化剂 | Ⅰ错;Ⅱ对;无 |
| D | 在空气中铁的表面能形成致密的氧化膜 | 铁不能与氧气反应 | Ⅰ对;Ⅱ对;有 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe3O4溶于足量稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O |
| B、NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O |
| C、向澄清石灰水中通入少量CO2:OH-+CO2=HCO3- |
| D、1mol/L的NaAlO2溶液和2.5 mol/L的HCl等体积均匀混合:2AlO2-+5H+=Al(OH)3↓+Al3++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、干馏煤可以得到甲烷、苯和氨等重要化工原料 |
| B、油脂、乙醇是人体所必须的营养物质 |
| C、纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应 |
| D、为推广氢能的使用,工业上可采用电解水法制取大量氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 叙述Ⅰ | 叙述Ⅱ | |
| A | NaHCO3能与碱反应 | 食品工业用NaHCO3作焙制糕点的膨松剂 |
| B | Al既可和酸反应又可和强碱反应 | Al可制成铝箔包装物品 |
| C | K2FeO4能与水作用生成Fe(OH)3胶体和O2 | 可K2FeO4用于净化自来水并杀菌消毒 |
| D | HClO具有弱酸性 | HClO可作漂白剂 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①>②>④>③>⑤ |
| B、③>①>④>②>⑤ |
| C、⑤>③>②>①>④ |
| D、③>④>⑤>②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:
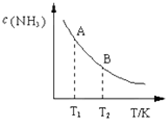 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产.生活中有着重要作用.请回答下列问题:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产.生活中有着重要作用.请回答下列问题:| 一定条件 |
| 时间/min 浓度/mol?L-1 | c (N2) | c (H2) | c (NH3) |
| 0 | 0.6 | 1.8 | 0 |
| 3 | 0.52 | x | 0.16 |
| 6 | 0.36 | 1.08 | 0.48 |
| 9 | 0.36 | 1.08 | 0.48 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com