
【题目】如图所示A处通入潮湿的Cl2,关闭活塞B时D中干燥的红色布条颜色无变化;打开活塞B时D处干燥的红色布条褪色,则C中的试剂(足量)不可能是

A.饱和氯化钠溶液B.氢氧化钙悬浊液C.饱和碳酸钠溶液D.浓硫酸
科目:高中化学 来源: 题型:
【题目】下列能用勒夏特列原理解释的是( )
A. 铁在潮湿的空气中易腐蚀
B. H2、I2、HI平衡混和气加压后颜色变深
C. 往往需要在催化剂条件下SO2氧化成SO3
D. 棕红色NO2加压后颜色先变深后变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.按如图所示装置进行实验,并回答下列问题:

(1)甲池,通入CH3OH(甲醇)的电极反应式为______________________。
(2)乙池中的总反应化学方程式为______________________。
(3)当甲池中消耗O20.56L(标准状况下)时,理论上乙池中B极的质量增加__________g;此时丙装置中___________(填“c”或“d”)电极折出1.20g金属,则按丙装置中的的某盐溶液可能是__________________(填序号)。
a.MgSO4溶液 b.CuSO4溶液 c.NaCl溶液 d.AgNO3溶液
Ⅱ.SO2、CO、CO2、NOx是对环境影响较大的几种气体,对它们的合理控利和治理是优化我们生存环境的有效途径。

(4)利用化学原理将C0、SO2转化为重要化工原料,装置如图所示:
①若A为CO,B为H2,C为CH3OH,则通入CO一极为____________________极。
②若A为SO2,B为O2,C为H2SO4,则负极的电极反应式为____________________。
③若A为NO2,B为O2,C为HNO3,则正极的电极反应式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有如下两个反应:a.NaOH+HCl=NaCl+H2O b.Cu+2Ag+ =Cu2+ +2Ag
(1)反应____(填字母)不能设计成原电池。原因是__________________________。
(2)a反应为______反应(填“放热”或“吸热”),NaOH和HCl的总能量________(填“大于”“小于”或“等于”)NaCl和H2O的总能量。
(3)已知HCl中H-Cl键的键能为431 kJ·mol-1,则断开1molH-Cl键_____431 kJ的能量,形成1molH-Cl键_____431 kJ的能量。(填“吸收”或“放出”)
(4)反应____(填字母)能设计成原电池,请画出实验装置图,注明电极材料和电解质溶液。__________

写出电极反应式及反应类型
正极反应式:_____________________,
反应类型:_______________________,
负极反应式:_____________________。
(5)上题所设计原电池中,向正极移动的离子为_______,电池工作一段时间后,电解质溶液质量减轻7.6g,正极增重的质量为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学——选修5:有机化学基础)
高血脂是一种常见的心血管疾病,治疗高血脂的新药I的合成路线如下:
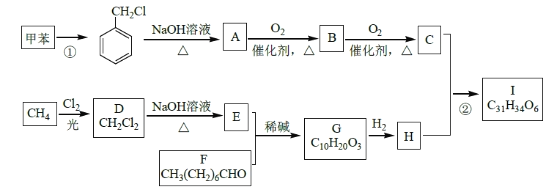

回答下列问题:
(1)反应①所需试剂、条件分别是____________;F 的化学名称为____________。
(2)②的反应类型是______________;A→B 的化学方程式为_____________________。
(3)G 的结构简式为______________;H 中所含官能团的名称是____________。
(4)化合物W的相对分子质量比化合物C大14,且满足下列条件,W的可能结构有___种。
①遇FeCl3 溶液显紫色 ②属于芳香族化合物 ③能发生银镜反应其中核磁共振氢谱显示有5 种不同化学环境的氢,峰面积比为2:2:2:1:1,写出符合要求的W 的结构简式____________。
(5)设计用甲苯和乙醛为原料制备![]() 的合成路线,其他无机试剂任选(合成路线常用的表示方式为:
的合成路线,其他无机试剂任选(合成路线常用的表示方式为:![]() )____________。
)____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g)![]() Z(g) △H<0,反应经60s达到平衡并生成0.3 mol Z,则下列说法中正确的是
Z(g) △H<0,反应经60s达到平衡并生成0.3 mol Z,则下列说法中正确的是
A. 以Y浓度变化表示的反应速率为0.0005 mol/(L·s)
B. 其他条件不变,将容器体积扩大至20 L,则Z的平衡浓度变为原来的1/2
C. 其他条件不变,将容器体积缩小至5L,平衡正向移动,平衡常数增大
D. 其他条件不变,升高温度逆反应速率加快,正反应速率减慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子反应广泛用于化学研究、工业生产、食品检验、环境保护等方面。
(1)向0.01mol·L-1 Ba(OH)2溶液中匀速逐滴加入0.01mol·L-1 H2SO4溶液直至过量,整个过程中混合溶液的导电能力(用I表示)可近似地用下图中的____________(填字母)曲线表示,发生反应的离子方程式为__________________________________。

(2)提纯后的粗盐中,还含有MgCl2、Na2SO4和CaCl2等可溶性杂质,欲通过下列流程得到较纯净的NaCl固体。

①操作a、操作d均用到玻璃棒,作用分别是____________、____________。
②固体Ⅲ是________(填化学式),加入过量Z溶液的目的是________________。
③操作e的名称是____________________。
④检验制得的NaCl晶体中是否含有Na2SO4的方法是__________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W 有如图所示的转化关系,则 X、W可能的组合有()
![]()
①C、O2②Na、O2③Fe、HNO3④S、O2⑤N2、O2⑥H2S、O2⑦NH3、O2
A.四项B.五项C.六项D.七项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了确定黄钾铁矾[KFe3(SO4)x(OH)y]的化学式,某兴趣小组设计了如下实验:

请回答:
(1)黄钾铁矾的化学式[KFe3(SO4)x(OH)y]中x=________,y=________。
(2)写出溶液B中所含溶质的化学式________。
(3)红褐色沉淀能溶于HI溶液,并发生氧化还原反应,写出该反应的离子方程式________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com