

| 1 |
| 8 |
| 74% |
| 56 |
| 26% |
| 59 |
| 2 |
| 3 |
| m |
| V |
| 1 |
| 8 |
| 74% |
| 56 |
| 26% |
| 59 |
| 2 |
| 3 |
| m |
| V |
| ||||
| a3 |
| 151.3 |
| a3NA |
| 151.3 |
| a3NA |


 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用氨水鉴别MgCl2溶液和AlCl3溶液 |
| B、用焰色反应鉴别Na2CO3固体和NaHCO3固体 |
| C、用BaCl2溶液鉴别AgNO3溶液和Na2SO4溶液 |
| D、用丁达尔效应鉴别FeCl3溶液和Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
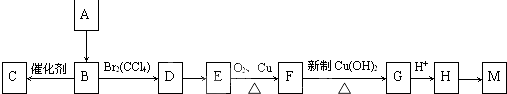
查看答案和解析>>
科目:高中化学 来源: 题型:
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ||||||
| 3 | ① | ③ | ④ | ⑦ | ⑨ | |||
| 4 | ② | ⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
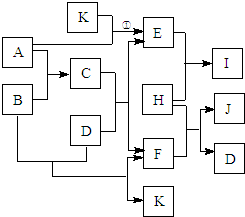 图中各物质均由常见元素(原子序数≤18)组成.已知A、B、K为单质,且在常温下A和K为气体,B为固体.D为常见的无色液体.I是一种常用的化肥,在其水溶液中滴加AgNO3溶液有不溶于稀HNO3的白色沉淀产生.J是一种厨房常用调味剂.它们的相互转化关系如图所示(图中反应条件未列出).请回答下列问题:
图中各物质均由常见元素(原子序数≤18)组成.已知A、B、K为单质,且在常温下A和K为气体,B为固体.D为常见的无色液体.I是一种常用的化肥,在其水溶液中滴加AgNO3溶液有不溶于稀HNO3的白色沉淀产生.J是一种厨房常用调味剂.它们的相互转化关系如图所示(图中反应条件未列出).请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com