
 以下是对化学反应变化过程及结果的研究.按要求回答问题:
以下是对化学反应变化过程及结果的研究.按要求回答问题:分析 (1)利用盖斯定律构造目标热化学方程式并求焓变;
(2)pH=a的氢氧化钠溶液中c(NaOH)=c(OH-)=10a-14mol/L,醋酸部分电离,则pH=b的醋酸溶液中c(醋酸)>10-bmol/L,酸碱恰好中和,则酸的物质的量与碱的物质的量相等,据此分析;醋酸的电离常数K=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$,c(醋酸)=c(NaOH),氢离子浓度已知,则可以计算出K;
(3)先分析溶液中的成分,再根据盐类的水解和电荷守恒来分析,注意盐类的水解是微弱的;
(4)氨气作燃料应充入负极区,碱性燃料电池氢氧根离子常参与电极反应,氨气中的N失去电子化合价升高,由于X无污染可以确定X为氮气,根据Kw=Kh×Kb代入计算即可,Kw与温度成正比,以此判断T与25℃的大小.
解答 解:(1)已知:甲醇脱水反应 ①2CH3OH(g)═CH3OCH3(g)+H2O(g)△H1=-23.9kJ•mol-1
甲醇制烯烃反应 ②2CH3OH(g)═C2H4(g)+2H2O(g)△H2=-29.1kJ•mol-1
乙醇异构化反应 ③C2H5OH(g)═CH3OCH3(g)△H3=+50.7kJ•mol-1,
根据盖斯定律①-②-③可得:C2H4(g)+H2O(g)═C2H5OH(g)△H=(-23.9+29.1-50.7)kJ/mol=-45.5kJ/mol,故答案为:-45.5kJ/mol;
(2)pH=a的氢氧化钠溶液中c(NaOH)=c(OH-)=10a-14mol/L,醋酸部分电离,则pH=b的醋酸溶液中c(醋酸)>10-bmol/L,酸碱恰好中和,则酸的物质的量与碱的物质的量相等,则c(NaOH)=c(OH-)=10a-14mol/L=c(醋酸)>10-bmol/L,所以10a-14>10-b,则a+b>14;c(醋酸)=c(NaOH)=10a-14mol/L,c(H+)=c(CH3COO-)=10-bmol/L,则醋酸的电离常数K=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$=$\frac{1{0}^{-b}•1{0}^{-b}}{1{0}^{a-14}-1{0}^{-b}}$=$\frac{1{0}^{-2b}}{1{0}^{a-14}-1{0}^{-b}}$,故答案为:>;$\frac{1{0}^{-2b}}{1{0}^{a-14}-1{0}^{-b}}$;
(3)100mL 3mol•L-1的NaOH的物质的量=3mol/L×0.1L=0.3mol,标准状况下4.48LCO2的物质的量=$\frac{4.48L}{22.4L/mol}$=0.2mol,这样OH-:2CO2=3:2;离子方程式为:3OH-+2CO2═CO32-+HCO3-+H2O;反应后的溶液就是0.1mol的NaHCO3和0.1mol的Na2CO3,无论碳酸钠还是碳酸氢钠,溶液都呈碱性,即:C(OH-)>C(H+),溶液中氢氧根离子有两个来源,一个是碳酸根离子水解,一个是碳酸氢根离子水解,碳酸根离子水解程度大于碳酸氢根离子的水解,所以C(HCO3-)>C(CO32-)>C(OH-),故溶液中各离子浓度大小顺序是C(Na+)>C(HCO3-)>C(CO32-)>C(OH-)>C(H+),
故答案为:3OH-+2CO2═CO32-+HCO3-+H2O;C(Na+)>C(HCO3-)>C(CO32-)>C(OH-)>C(H+);
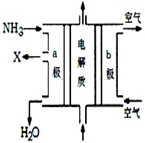
(4)在燃料电池中,可燃物充入负极区,所以NH3充入的a极作负极,产生的X气体为氧化产物,可直接排放到大气中,说明X对大气无污染,因此X为氮气,由该燃料电池示意图可知负极反应产物有水,由于是碱性电池,氢氧根离子也参与负极电极反应,综上所述可写出负极反应式:2NH3+6OH--6e-=N2+6H2O;根据公式Kw=Kh×Kb,T℃下Kw=1.5×10-8×1.8×10-5=2.7×10-13;水的电离是吸热的,所以温度越高Kw越大,由于2.7×10-13>1.0×10-14,所以T>25℃,
故答案为:2NH3+6OH--6e-=N2+6H2O;2.7×10-13;>.
点评 本题考查了盖斯定律的应用、酸碱混合溶液的有关计算,难度不大,侧重于考查学生对知识的综合应用能力和数据处理能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 43.2 g | B. | 46.8 g | C. | 53.6 g | D. | 63.8 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
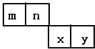 m、n、x、y四种主族元素在周期表里的相对位置如图所示,已知它们的原子序数总和为46,则:
m、n、x、y四种主族元素在周期表里的相对位置如图所示,已知它们的原子序数总和为46,则: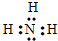 ,空间构型为三角锥形.
,空间构型为三角锥形.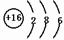 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
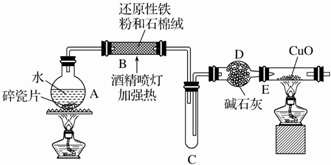
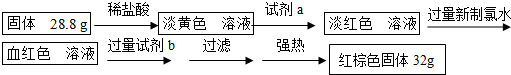
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 金属冶炼和处理常涉及氧化还原反应.
金属冶炼和处理常涉及氧化还原反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置.其材料除单晶硅,还有铜铟镓硒等化合物.
太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置.其材料除单晶硅,还有铜铟镓硒等化合物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
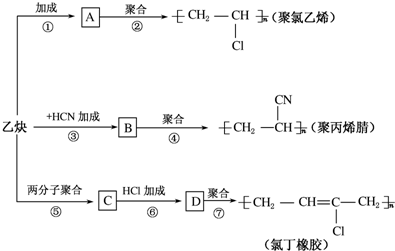

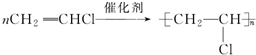 ;
;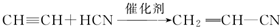 ;
;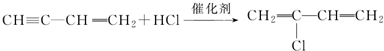 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②③④ | C. | ①③④ | D. | ②④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com