
【题目】工业制硫酸的过程中,SO2催化氧化的原理为:2SO2(g) + O2(g) ![]() 2SO3(g) + Q
2SO3(g) + Q ![]()
(1)若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化。(选填“增大”、“减小”或“不变”)
|
| 平衡常数K |
________ | ________ | ________ |
(2)2SO2(g) + O2(g) ![]() 2SO3(g)过程的能量变化如图所示。下列说法正确的是_________
2SO3(g)过程的能量变化如图所示。下列说法正确的是_________
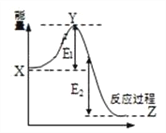
A.加入催化剂,X点位置升高
B.反应热 = E1 + E2
C.反应物总能量低于生成物
D.加入催化剂,E2不变
(3)将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应得到如下表中的两组数据:
实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | ||
SO2 | O2 | SO2 | O2 | ||
1 | T1 | 4 | 2 | x | 0.8 |
2 | T2 | 4 | 2 | 0.4 | y |
实验1从开始到反应达到化学平衡时,用去时间2分钟,则υ(SO2)表示的反应速率为_________;T1________T2(填“>”、“<”或“=”)。制取SO2的尾气用NaOH溶液吸收,可得到Na2SO3和NaHSO3两种盐。
(4)0.1mol/L的NaHSO3溶液中c(H+) > c(OH-),用水解和电离理论的角度解释其原因___________________;若往溶液中加入氨水至中性,则c(Na+)______c(HSO3-) + c(SO32-) + c(H2SO3)(填“>”、“﹤”或“=”)。
(5)往0.1 mol/L的Na2SO3溶液加入少量Na2SO3固体,完全溶解后溶液中c(Na+) : c(SO32-)的比值____________(填“变大”、“变小”或“保持不变”)。
【答案】 增大 增大 减小 D 0.6mol/(L· min) > HSO3-的电离程度大于水解程度 = 变小
【解析】试题分析: (1) 2SO2(g) + O2(g) ![]() 2SO3(g) ,升高温度反应速率增大,正反应放热,升高温度平衡逆向移动。(2)
2SO3(g) ,升高温度反应速率增大,正反应放热,升高温度平衡逆向移动。(2)
加入催化剂,降低活化能,催化剂不能改变反应焓变;(3)反应速率为根据![]() 计算;(4)HSO3-水解呈碱性,HSO3-电离呈酸性;NaHSO3中满足钠元素的物质的量与硫元素的物质的量相等;(5)SO32-浓度越大,水解程度越小。
计算;(4)HSO3-水解呈碱性,HSO3-电离呈酸性;NaHSO3中满足钠元素的物质的量与硫元素的物质的量相等;(5)SO32-浓度越大,水解程度越小。
解析: (1) 温度从300℃升至400℃,正逆反应速率均增大,升高温度平衡逆向移动,所以平衡常数减小;(2)加入催化剂,降低活化能,Y点位置降低,X点位置不变,故A错误;
反应热生成物的总能量减反应物的总能量= -E2,故B错误;
C.反应放热,反应物总能量大于生成物,故C错误;
D.催化剂不能改变反应焓变,加入催化剂,E2不变,故D正确;
(3)

υ(SO2)表示的反应速率为![]() =
=![]() 0.6mol/(L· min);
0.6mol/(L· min);
2SO2(g) + O2(g) ![]() 2SO3(g) 正反应放热,所以升高温度平衡逆向移动,
2SO3(g) 正反应放热,所以升高温度平衡逆向移动, ![]() 平衡时SO2的浓度0.8 mol/L大于
平衡时SO2的浓度0.8 mol/L大于![]() 平衡时SO2的浓度,所以
平衡时SO2的浓度,所以![]() >
>![]() ;(4)HSO3-水解呈碱性,HSO3-电离呈酸性;电离大于水解所以溶液呈酸性;往NaHSO3溶液中加入氨水至中性,根据物料守恒,c(Na+)=c(HSO3-) + c(SO32-) + c(H2SO3);(5)SO32-浓度越大,水解程度越小;往0.1 mol/L的Na2SO3溶液加入少量Na2SO3固体,完全溶解后溶液中c(Na+) : c(SO32-) 的比值变小;
;(4)HSO3-水解呈碱性,HSO3-电离呈酸性;电离大于水解所以溶液呈酸性;往NaHSO3溶液中加入氨水至中性,根据物料守恒,c(Na+)=c(HSO3-) + c(SO32-) + c(H2SO3);(5)SO32-浓度越大,水解程度越小;往0.1 mol/L的Na2SO3溶液加入少量Na2SO3固体,完全溶解后溶液中c(Na+) : c(SO32-) 的比值变小;


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
【题目】酯类是工业上重要的有机原料,具有广泛用途。下图是乙酸乙酯的合成路线图,已知A能与银氨溶液反应析出银镜,B的水溶液可以溶解CaCO3,E可作果实催熟剂。

请完成下列问题:
(1)A的名称是_________;B中所含的官能团是____________;反应③的类型是_____________;反应④的类型是_____________。
(2)A的结构简式为___________________;E的结构简式为_________________________。
(3)请写出反应①、③、④的化学方程式:
①__________________________________________________________。
③__________________________________________________________。
④__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.氯化钠溶液能导电,所以氯化钠溶液是电解质
B.氯化钠固体不导电,所以氯化钠不是电解质
C.氯化氢溶液能导电,所以氯化氢是电解质
D.氯气溶于水能导电,所以氯气是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国明代《本草纲目》中收载药物1892种,其中“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上…其清如水,味极浓烈,盖酒露也.”这里所用的“法”是指( )
A.萃取
B.渗析
C.蒸馏
D.干馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、社会密切相关。下列有关说法正确的是
A. 在人体内酶的作用下,纤维素可以发生水解生成葡萄糖
B. 福尔马林(甲醛溶液)可用于浸泡生肉及海产品以防腐保鲜
C. 新型材料聚酯纤维、光导纤维都属于有机高分子材料
D. 医药中常用酒精来消毒,是因为酒精能够使病毒的蛋白质发生变性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室获取氮气有很多种途径,常见的3种方法是:
方法一:将氨气通入灼热的氧化铜粉末,得到纯净的氮气和铜;
方法二:将空气通过灼热的铜,得到较纯净的氮气和氧化铜粉末;
方法三:将亚硝酸钠(NaNO2)和氯化铵的混合溶液加热,氮元素全部转化为氮气。进行实验时可选择的实验仪器如下图所示(省略夹持装置与加热装置):
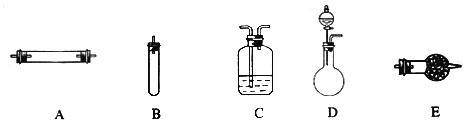
(1)方法一:制氮气所需的氨气可以用浓氨水滴加到生石灰中得到,此反应的发生装置最好选用________________(选填装置编号)。请写出生石灰在此反应中的两个作用____________、___________。
(2)方法二:为保证所得氮气尽可能纯净,除了使用铜外,还可以向装置__________(选填装置编号)中加入____以除去其它杂质气体。
(3)方法三:制氮气的化学方程式为_____________________________。
(4)绿色化学是指在制造和应用化学产品时应有效利用(最好可再生)原料,消除废物和避免使用有毒的和危险的试剂与溶剂。在制取氮气的3种方法中,联合使用方法一和方法二与单独使用方法三相比,具有很多优越性,请从绿色化学的角度进行评价:______________。
(5)1892年,英国科学家瑞利(( Rayleigh)发现,采用方法二得到的氮气在相同条件下比方法三得到的氮气密度总是偏大50‰左右。若上述实验设计与操作均无错误,且氮气已完全干燥,请解释产生这一现象的原因:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分:
IA | IIA | ⅢA | IVA | VA | VIA | VIIA | ||
二 | C | N | ① | |||||
三 | ② | ③ | ④ | P | ⑤ | ⑥ |
请填写下列空白:
(1)表中元素,原子半径最大的是_______________(填写元素符号);①的核外电子排布式_______;③和⑥两元素形成化合物的电子式为________。
(2)②③④三种元素最高价氧化物对应的水化物中,碱性最强的是__________(填化学式)。
(3)比较④、⑤两种元素的简单离子半径:___>____(填离子符号);元素④最高价氧化物对应的水化物与硝酸反应的离子方程式为__________________。
(4)列举一个事实来证明元素①比元素⑤的非金属性强__________________。
(5)若8g甲烷气体完全燃烧生成液态水时放出445.15kJ的热量,请写出其热化学方程式___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com