
| A. | 用手接触药品 | |
| B. | 用嘴吹灭酒精灯 | |
| C. | 洒在桌面上的酒精燃烧,立即用湿抹布盖灭 | |
| D. | 将带有溶液的滴管平放在实验台上 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 molFe与过量的氯气反应,转移电子的数目为2 NA | |
| B. | 2.24LCO和CO2混合气体中含有的碳原子数目为0.1NA | |
| C. | 1.0L0.1 mol•L-1Na2S溶液中含有的S2-离子数小于0.1NA | |
| D. | 50mL18.4mol•L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.17 | 0.14 | 0.11 | 0.10 | 0.07 |
| 主要 化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | L2+与R2-的核外电子数相等 | |
| B. | M与Q在同一周期 | |
| C. | M与T形成的化合物具有两性 | |
| D. | 最高价氧化物对应水化物的碱性:L<Q |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 红磷在空气中燃烧:发出白光,生成大量的白色烟雾 | |
| B. | 碳酸钠溶液与氢氧化钙溶液反应:溶液中产生气泡 | |
| C. | 氢气在空气中燃烧:无色气体燃烧,发出淡蓝色火焰,放热 | |
| D. | 镁条在空气中燃烧:银白色固体燃烧,生成白色固体氧化镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 s | B. | 2 s | C. | 44 s | D. | 1.33 s |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32.0% | B. | 22.0% | C. | 45.0% | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
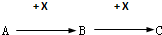
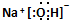 .
.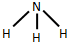 ,写出A生成B的反应方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
,写出A生成B的反应方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com