
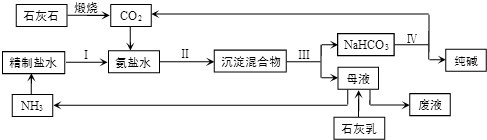
分析 (1)将硫酸钠、石灰石和足量煤混合,高温下共熔制得碳酸钠,反应有硫化钙生成,S元素发生还原反应,C发生氧化反应生成CO;
(2)石灰水煅烧得到二氧化碳,食盐水中通入氨气,溶液呈碱性,有利于吸收二氧化碳,增大溶液中HCO3-,析出NaHCO3晶体,过滤分离,母液中含有NH4Cl,碳酸氢钠加热分解得到纯碱,同时生成二氧化碳,向母液中加入石灰乳得到氨气,二氧化碳、氨气循环利用.
①用氢氧化钙沉淀镁离子,再用碳酸钠沉淀钙离子;
②NaHCO3、NH4Cl、NH4HCO3、NaCl四种物质中,NaHCO3溶解度最小,析出中NaHCO3晶体,同时生成氯化铵;该工艺中循环利用的物质是氨气与二氧化碳;
③工艺流程中不需要沸腾炉,工业制备硫酸用到沸腾炉;
④NaHCO3未完全析出,母液中的Na随废液排出等导致食盐损失;
母液中含有氯化铵,通入NH3并加入食盐固体,有利于氯化铵析出,降温结晶得到副产品为氯化铵;
(3)称量样品的质量,加热分解完成,测定分解后样品质量,根据固体质量差可以计算碳酸氢钠的质量,进而计算样品中碳酸氢钠的质量分数.
解答 解:(1)将硫酸钠、石灰石和足量煤混合,高温下共熔制得碳酸钠,反应有硫化钙生成,S元素发生还原反应,C发生氧化反应生成CO,反应方程式为:Na2SO4+CaCO3+4C $\frac{\underline{\;高温\;}}{\;}$ Na2CO3+CaS+4CO↑,
故答案为:Na2SO4+CaCO3+4C $\frac{\underline{\;高温\;}}{\;}$ Na2CO3+CaS+4CO↑;
(2)石灰水煅烧得到二氧化碳,食盐水中通入氨气,溶液呈碱性,有利于吸收二氧化碳,增大溶液中HCO3-,析出NaHCO3晶体,过滤分离,母液中含有NH4Cl,碳酸氢钠加热分解得到纯碱,同时生成二氧化碳,向母液中加入石灰乳得到氨气,二氧化碳、氨气循环利用.
①精制盐水需要,用氢氧化钙沉淀镁离子,再用碳酸钠沉淀钙离子,
故答案为:Ca(OH)2(或CaO);Na2CO3;
②NaHCO3、NH4Cl、NH4HCO3、NaCl四种物质中,NaHCO3溶解度最小,析出中NaHCO3晶体,同时生成氯化铵,反应方程式为:NH3•H2O+NaCl+CO2=NaHCO3↓+NH4Cl,该工艺中循环利用的物质是氨气与二氧化碳,
故答案为:NH3•H2O+NaCl+CO2=NaHCO3↓+NH4Cl;常温下,NaHCO3、NH4Cl、NH4HCO3、NaCl四种物质中,NaHCO3溶解度最小;CO2、NH3;
③工艺流程中不需要沸腾炉,工业制备硫酸用到沸腾炉,盐水吸收氨气用到吸氨塔,母液中得到氨气用蒸氨塔,铵盐水吸收二氧化碳用到碳酸化塔,石灰水煅烧需要石灰窑,
故答案为:D;
④该工艺中食盐利用率大约只有70%,食盐损失的主要原因是:NaHCO3未完全析出,母液中的Na随废液排出;
母液中含有氯化铵,通入NH3并加入食盐固体,有利于氯化铵析出,降温结晶得到副产品为氯化铵,
故答案为:NaHCO3未完全析出,母液中的Na随废液排出; NH4Cl;
(3)称量样品的质量m1,加热分解完成,测定分解后样品质量m2,根据固体质量差可以计算碳酸氢钠的质量,进而计算样品中碳酸氢钠的质量分数.
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O 固体质量建设
168 62
m (m1-m2)
则m=$\frac{168({m}_{1}-{m}_{2})}{62}$,
故样品中碳酸氢钠的质量分数为$\frac{\frac{168({m}_{1}-{m}_{2})}{62}}{{m}_{1}}$=$\frac{84({m}_{1}-{m}_{2})}{31{m}_{1}}$,
故答案为:$\frac{84({m}_{1}-{m}_{2})}{31{m}_{1}}$( m1是样品质量,m2是样品受热分解后的质量).
点评 本题考查化学与技术,关键是对原理的理解,涉及物质的分离提纯、物质含量测定等,理解掌握中学常见化学工业,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
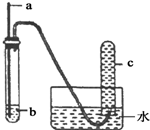 用下图所示装置进行实验,实验现象对应的结论正确的是( )
用下图所示装置进行实验,实验现象对应的结论正确的是( )| a | b | 实验现象 | 结论 | |
| A | 铜丝 | 稀硝酸 | c中收集到大量无色气体 | 稀硝酸与铜反应生成NO2 |
| B | 木条 | 18.4mol/L浓硫酸 | 木条变黑 | 浓硫酸具有酸性 |
| C | 铁钉 | 饱和食盐水 | 部分水进入导管 | 铁钉发生吸氧腐蚀 |
| D | 铝片 | 浓硝酸 | 无明显现象 | 铝与浓硝酸不反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1molCl2溶于足量水中,转移的电子数为0.1NA | |
| B. | 标准状况下,11.2LCH3CH2OH的分子数为0.5NA | |
| C. | 0.1mol由16O2和18O2组成的氧气中含有氧原子的数目为0.2NA | |
| D. | 1L0.5mol•L-1Na2SO4溶液中阴离子所带电荷数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol/L | B. | 0.8mol/L | C. | 1.0mol/L | D. | 1.5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 反应中氯气只起氧化剂的作用 | |
| B. | 溶液Ⅰ的溶质是KClO | |
| C. | 生成反应液II中的反应氧化剂与还原剂的物质的量之比为1:1 | |
| D. | 溶液Ⅱ的溶液成分中含有K2FeO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com