
【题目】有机物A的相对分子质量不超过150,经测定可知A具有下列性质:
A所具有的性质 | 由此推出的A的组成或结构 |
①A能燃烧,燃烧产物只有CO2和H2O | |
②A与醇或羧酸在浓硫酸存在条件下发生反应均能生成有香味的物质 | |
③在一定条件下,A能发生分子内的脱水反应,生成物能使溴的CCl4溶液退色 | |
④0.1 mol A与足量NaHCO3溶液反应放出标准状况下4.48L气体 |
(1)填写表中空白_____________、__________________ 、_______________________。
(2)已知A分子中氧元素的质量分数为59.7%,则A的分子式为______________。
(3)假设A的结构式中不含碳支链,写出③中A所发生反应的化学方程式:__________________。
【答案】A中一定含有C、H,可能含有O A分子中含有-OH、-COOH A分子中含有两个-COOH C4H6O5 ![]()
【解析】
(1)由①中A燃烧产物只有CO2和H2O,根据原子守恒可知A中一定含有C、H,可能含有O。
答案为:A中一定含有C、H,可能含有O。
由②中A与醇或羧酸反应均能生成有香味的物质,可知A分子中含有—OH、—COOH。
答案为:A分子中含有—OH、—COOH。
由④中数据及反应R—COOH+HCO3—→CO2↑+H2О+R—COO-可知A分子中含有两个—COOH。
答案为:A分子中含有两个—COOH。
(2)设A的分子式为CxHyOz,由于16z ≤150×59.7%,即z ≤5.6,结合(1)中的分析,可知z=5,则A的相对分子质量为5×16/59.7%=134。因A分子中含有2个—COOH、1个—OH,故剩余基团的相对分子质量为134-90-17=27,剩余基团的组成为C2H3,所以A的分子式为C4H6O5。
答案为:C4H6O5。
(3)不含碳支链的A的结构简式为![]() ,发生分子内的脱水反应时生成不饱和二元酸,化学方程式为:
,发生分子内的脱水反应时生成不饱和二元酸,化学方程式为:![]() 。
。


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案科目:高中化学 来源: 题型:
【题目】二次电池锂离子电池广泛应用于手机和电脑等电子产品中。某常见锂离子电池放电时电池的总反应为:Li1-xCoO2+LixC6=LiCoO2+ C6(x<1)。2018年中国回收了全球可回收锂离子电池总量的69%。但现阶段我国废旧电池回收仍属于劳动密集型产业,效率仍需提高。一种回收该锂离子电池中的锂和钴的流程:
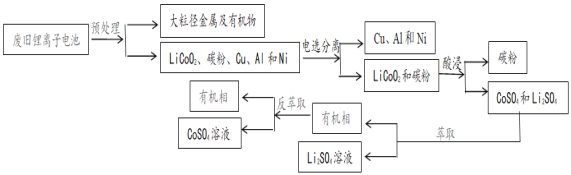
已知:① Na2S2O3是一种中等强度的还原剂,遇强酸分解
② Li2CO3溶解度随温度升高而减小
(1)关于该锂离子电池说法不正确的是_______________________________
A.锂离子电池中无金属锂,充放电过程中,Li+在两个电极之间往返嵌入和脱嵌
B.集中预处理时,为防止短时间内快速放电引起燃烧甚至爆炸,应先进行放电处理
C.充电时若转移0.01mol电子,石墨电极将减重0.07g
D.充电时,阳极的电极反应式为LiCoO2-xe-===Li1-xCoO2+xLi+
(2)LiCoO2是一种具有强氧化性的难溶复合金属氧化物,且Co3+在常温、pH=0.5条件下即开始水解。LiCoO2可溶于硫酸得CoSO4。用硫酸酸浸时,需要加入Na2S2O3作助溶剂,从化学反应原理的角度解释原因:_______________________________,写出浸出CoSO4的离子反应方程式:__________________
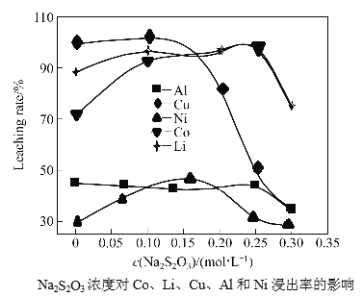
(3)控制氢离子浓度为4mol/L,反应温度90℃,测得相同时间内离子的浸出率与Na2S2O3溶液的变化关系如图。则酸浸时应选用浓度为_______mol/L的Na2S2O3溶液。Na2S2O3溶液浓度增至0.3mol/L时,LiCoO2的浸出率明显下降,可能的原因是_________________(用化学方程式结合文字说明)
(4)整个回收工艺中,可循环使用的物质是_____________________
(5)已知15℃左右Li2CO3的Ksp为3.210-2,该温度下Li2CO3的溶解度约为_____g。将萃取后的Li2SO4溶液加热至95℃,加入饱和Na2CO3溶液,反应10min,________________(填操作)得Li2CO3粉末。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科研人员设想利用如图所示的装置生产硫酸,下列有关说法正确的是( )
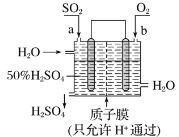
A.a 为正极,b 为负极
B.生产过程中氢离子由右移向左
C.从左下口流出的硫酸的质量分数一定大于 50%
D.负极反应式为 SO2+2H2O-2e-=SO42-+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在有机化学中广泛采用系统命名法,根据系统命名法原则,回答下列问题:
①系统命名法命名下列物质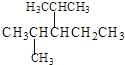 ___;
___;
②3,4-二甲基-2-戊烯的结构简式是___;
(2)![]() 中含有的官能团的名称为__。
中含有的官能团的名称为__。
(3)按要求书写下列化学方程式:
①甲苯制备TNT___;
②实验室制备乙烯___。
(4)下列物质的沸点按由高到低的顺序排列正确的是__。
①CH3(CH2)2CH3 ②CH3(CH2)3CH3 ③(CH3)3CH ④(CH3)2CHCH2CH3
A.④③②① B.②④③① C.②④①③ D.④②①③
(5)现有下列6种与人们生产生活相关的有机物:①CH3COOH(调味剂)②HCOOCH3(烟草熏蒸剂)③![]() (制酚醛树脂)④
(制酚醛树脂)④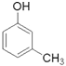 (生产杀虫剂)⑤CH2=CH-CH=CH2(合成橡胶原料)⑥HCHO(防腐剂)。其中与①互为同分异构体的是___(填序号)。
(生产杀虫剂)⑤CH2=CH-CH=CH2(合成橡胶原料)⑥HCHO(防腐剂)。其中与①互为同分异构体的是___(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数值,下列叙述中正确的
A.0.4 mol NH3与0.6 mol O2在催化剂的作用下充分反应,得到NO的分子数为0.4NA
B.C60和石墨的混合物共1.8 g,含碳原子数目为0.15NA
C.1 L 0.1 mol/LNH4Al(SO4)2溶液中阳离子总数小于0.2NA
D.5.6 g铁在足量的O2中燃烧,转移的电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.原子最外层电子数为2的元素一定处于周期表IIA族
B.水分子和氨气分子中,中心原子的杂化方式相同
C.2p能级有两个未成对电子和3p能级有两个未成对电子的原子对应的元素属于同一主族
D.M层全充满而N层为![]() 的原子对应的元素为K
的原子对应的元素为K
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. HF、HCl、HBr、HI的熔沸点依次升高
B. CH4、CCl4都是含有极性键的非极性分子
C. CS2、H2S、C2H2都是直线形分子
D. 氯的各种含氧酸的酸性由强到弱排列为HClO>HClO2>HClO3>HClO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2催化加氢制甲醇,是极具前景的温室气体资源化研究领域。在某CO催化加氢制甲醇的反应体系中,发生的主要反应有:
i.CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H1=-49.4kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.4kJ·mol-1
ⅱ.CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H2=+41.2kJ·mol-1
CO(g)+H2O(g) △H2=+41.2kJ·mol-1
ⅲ.CO(g)+2H2(g) ![]() CH3OH(g) △H3
CH3OH(g) △H3
(1)△H3________ kJ·mol-1
(2)5MPa时,往某密闭容器中按投料比n(H2):n(CO2)=3:1充入H2和CO2。反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。
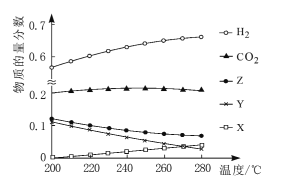
①体系中CO2的物质的量分数受温度的影响不大,原因是____。
②250℃时,反应ii的平衡常数____1(填“>”“<”或“=”)。
③下列措施中,无法提高甲醇产率的是____(填标号)。
A 加入适量CO B 增大压强 C 循环利用原料气 D 升高温度
④如图中X、Y分别代表____(填化学式)。
(3)反应i可能的反应历程如下图所示。
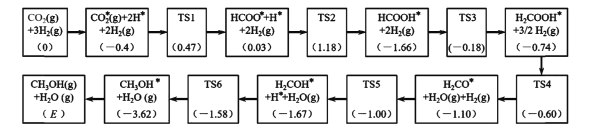
注:方框内包含微粒种类及数目、微粒的相对总能量(括号里的数字或字母,单位:eV)。其中,TS表示过渡态、*表示吸附在催化剂上的微粒。
①反应历程中,生成甲醇的决速步骤的反应方程式为____。
②相对总能量E=____(计算结果保留2位小数)。(已知:leV=1.6×10-22kJ)
(4)用电解法也可实现CO2加氢制甲醇(稀硫酸作电解质溶液)。电解时,往电解池的____极通入氢气,阴极上的电极反应为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,将A和B各0.32mol充入恒容密闭容器中,发生反应:A(g)+B(g)![]() 2C(g)△H=-akJ·mol-1(a>0),反应过程中测定的数据如下表,下列说法正确的是( )
2C(g)△H=-akJ·mol-1(a>0),反应过程中测定的数据如下表,下列说法正确的是( )
t/min | 0 | 2 | 4 | 7 | 9 |
n(B)/mol | 0.32 | 0.24 | 0.22 | 0.20 | 0.20 |
A.若起始时向容器中充入0.64molC,则达平衡时吸收的热量为0.12akJ
B.恒温,如果压缩容器体积,B的浓度和体积分数均不变
C.若起始时向容器中充入0.64molA和0.64molB,则达平衡时n(C)<0.40mol
D.恒温、恒容,向平衡体系中再充入0.32molA,再次平衡时,B的转化率增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com