
”¾ĢāÄæ”æĖęŌ×ÓŠņŹżµÄµŻŌö£¬°ĖÖÖ¶ĢÖÜĘŚŌŖĖŲ£ØÓĆ×ÖÄøX±ķŹ¾£©Ō×Ó°ė¾¶µÄĻą¶Ō“óŠ””¢×īøßÕż¼Ū»ņ×īµĶøŗ¼ŪµÄ±ä»ÆČēĻĀ×óĶ¼ĖłŹ¾£¬øł¾ŻÅŠ¶Ļ³öµÄŌŖĖŲ»Ų“šĪŹĢā£ŗ

¢Å fŌŚŌŖĖŲÖÜĘŚ±ķµÄĪ»ÖĆŹĒ__________”£
¢Ę ±Č½Ļd”¢e³£¼ūĄė×ӵİė¾¶µÄŠ”£ØÓĆ»ÆѧŹ½±ķŹ¾£¬ĻĀĶ¬£©_______£¾__________±Č½Ļg”¢hµÄ×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦µÄĖ®»ÆĪļµÄĖįŠŌĒæČõŹĒ£ŗ_______£¾__________
¢Ē ČĪŃ”ÉĻŹöŌŖĖŲ×é³ÉŅ»ÖÖĖÄŌ×Ó¹²¼Ū»ÆŗĻĪļ£¬Š“³öĘäµē×ÓŹ½____________________
¢Č ŅŃÖŖ1moleµÄµ„ÖŹŌŚ×ćĮæd2ÖŠČ¼ÉÕ£¬»Öø“ÖĮŹŅĪĀ£¬·Å³ö255.5kJČČĮ棬Š“³öøĆ·“Ó¦µÄČČ»Æѧ·½³ĢŹ½____________
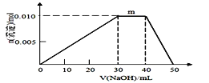
¢É ÉĻŹöŌŖĖŲæÉ×é³ÉŃĪR£ŗzx4f(gd4)2£¬ĻņŹ¢ÓŠ10mL1mol”¤L-1RČÜŅŗµÄÉÕ±ÖŠµĪ¼Ó1mol”¤L-1NaOHČÜŅŗ£¬³ĮµķĪļÖŹµÄĮæĖęNaOHČÜŅŗĢå»ż±ä»ÆŹ¾ŅāĶ¼ČēÉĻÓŅĶ¼ĖłŹ¾£ŗ
¢Ł RČÜŅŗÖŠĄė×ÓÅضČÓɓ󵽊”µÄĖ³ŠņŹĒ________________
¢Ś Š“³ömµć·“Ó¦µÄ¶ųĄė×Ó·½³ĢŹ½________________________________
¢Ū ČōRČÜŅŗøļÓ20mL1.2 mol”¤L-1Ba(OH)2ČÜŅŗ£¬³ä·ÖÖŠ²śÉś³ĮµķµÄĪļÖŹµÄĮæĪŖ_______mol”£
”¾“š°ø”æµŚČżÖÜĘŚ¢óA×å r(O2-) r(Na+) HClO4 H2SO4 ![]() 2Na(s)+O2(g) £½Na2O2(s) ”÷H=-511kJ”¤mol-1 c(SO42-)£¾c(NH4+)£¾c(Al3+)£¾c(H+)£¾c(OH-) NH4+ + OH-£½NH3”¤H2O 0.022
2Na(s)+O2(g) £½Na2O2(s) ”÷H=-511kJ”¤mol-1 c(SO42-)£¾c(NH4+)£¾c(Al3+)£¾c(H+)£¾c(OH-) NH4+ + OH-£½NH3”¤H2O 0.022
”¾½āĪö”æ
xµÄŌ×ÓŠņŹż×īŠ”£¬Ō×Ó°ė¾¶Ņ²×īŠ”£¬ĒŅ×īøßÕż»ÆŗĻ¼ŪĪŖ+1¼Ū£¬ŌņXŹĒH£¬eµÄ×īøßÕż»ÆŗĻ¼ŪĪŖ+1¼Ū£¬Ō×Ó°ė¾¶×ī“ó£¬ŌņeŹĒNa£¬yµÄŌ×ÓŠņŹż±ČeŠ”£¬×īøßÕż¼ŪĪŖ+4¼Ū£¬ŌņyŹĒC£¬zµÄŌ×ÓŠņŹżĀŌ“óÓŚy£¬×īøßÕż»ÆŗĻ¼ŪĪŖ+5¼Ū£¬ŌņzŹĒN£¬dŹĒO£¬fŌ×ÓŠņŹż±ČÄĘ“ó£¬×īøßÕż»ÆŗĻ¼ŪĪŖ+3¼Ū£¬ŌņfŹĒAl£¬gµÄ×īµĶøŗ»ÆŗĻ¼ŪĪŖ-2¼Ū£¬Ō×ÓŠņŹż±ČĀĮ“ó£¬ŌņgŹĒS£¬h×īµĶøŗ¼ŪĪŖ-1¼Ū£¬Ō×ÓŠņŹż“óÓŚĮņ£¬ŌņhŹĒCl£¬ÓÉ“Ė·ÖĪö½ā“š”£
“ÓĶ¼ÖŠµÄ»ÆŗĻ¼Ū”¢Ō×Ó°ė¾¶µÄ“󊔼°Ō×ÓŠņŹż£¬æÉŅŌÖŖµĄxŹĒHŌŖĖŲ£¬yŹĒCŌŖĖŲ£¬zŹĒNŌŖĖŲ£¬dŹĒOŌŖĖŲ£¬eŹĒNaŌŖĖŲ£¬fŹĒAlŌŖĖŲ£¬gŹĒSŌŖĖŲ£¬hŹĒClŌŖĖŲ£¬
(1)fŹĒAlŌŖĖŲ£¬Ō×ÓŗĖĶāÓŠ3øöµē×Ó²ć£¬×īĶā²ćµē×ÓŹżĪŖ3£¬ŌŚŌŖĖŲÖÜĘŚ±ķµÄĪ»ÖĆŹĒµŚČżÖÜĘŚ¢óA×壬
Ņņ“Ė£¬±¾ĢāÕżČ·“š°øŹĒ£ŗµŚČżÖÜĘŚ¢óA×壻
(2)µē×Ó²ć½į¹¹ĻąĶ¬µÄĄė×Ó£¬ŗĖµēŗÉŹżŌ½“óĄė×Ó°ė¾¶Ō½Š”£¬¹ŹĄė×Ó°ė¾¶£ŗr(O2-)>r(Na+) £»·Ē½šŹōŠŌŌ½Ē棬×īøß¼ŪŃõ»ÆĪļĖ®»ÆĪļµÄĖįŠŌŌ½Ē棬¹ŹĖįŠŌ£ŗHClO4 >H2SO4£¬
Ņņ“Ė£¬±¾ĢāÕżČ·“š°øŹĒ£ŗr(O2-)>r(Na+)£»HClO4 >H2SO4£»
(3)xÓėzŠĪ³ÉĖÄŌ×Ó¹²¼Ū»ÆŗĻĪļĪŖNH3£¬µē×ÓŹ½ĪŖ![]() £¬
£¬
Ņņ“Ė£¬±¾ĢāÕżČ·“š°øŹĒ£ŗ![]() £»
£»
(4)ŅŃÖŖ1molÄʵĵ„ÖŹŌŚ×ćĮæŃõĘųÖŠČ¼ÉÕ£¬Éś³É¹żŃõ»ÆÄĘ¹ĢĢ壬»Öø“ÖĮŹŅĪĀ£¬·Å³ö255.5kJČČĮ棬ĖłŅŌ·“Ó¦µÄČČ»Æѧ·½³ĢŹ½ĪŖ£ŗ2Na(s)+O2(g) £½Na2O2(s) ”÷H=-511kJ”¤mol-1£¬
Ņņ“Ė£¬±¾ĢāÕżČ·“š°øŹĒ£ŗ2Na(s)+O2(g) £½Na2O2(s) ”÷H=-511kJ”¤mol-1£»
£Ø5£©¢Ł1molNH4Al(SO4)2ŗ¬ÓŠ1molNH4+”¢1molAl3+”¢2molSO42-£¬ĖłŅŌĮņĖįøłĄė×ÓÅضČ×īøߣ¬ŅņĪŖ¼īŠŌNH3![]() H2O>Al(OH)3£¬øł¾Ż”°Ō½ČõŌ½Ė®½ā”±æÉÖŖAl3+Ė®½ā³Ģ¶Č“óÓŚNH4+Ė®½ā³Ģ¶Č£¬Ōņc(NH4+)£¾c(Al3+)£¬Al3+ŗĶNH4+Ė®½ā¶¼Éś³ÉĒāĄė×Ó£¬ČÜŅŗĻŌĖįŠŌ£¬ĖłŅŌĒāĄė×ÓµÄÅØ¶Č“óÓŚĒāŃõøłÅØ¶Č£¬ČÜŅŗÖŠĄė×ÓÅØ¶Č“óŠ”Ė³ŠņĪŖ£ŗc(SO42-)£¾c(NH4+)£¾c(Al3+)£¾c(H+)£¾c(OH-) ”£
H2O>Al(OH)3£¬øł¾Ż”°Ō½ČõŌ½Ė®½ā”±æÉÖŖAl3+Ė®½ā³Ģ¶Č“óÓŚNH4+Ė®½ā³Ģ¶Č£¬Ōņc(NH4+)£¾c(Al3+)£¬Al3+ŗĶNH4+Ė®½ā¶¼Éś³ÉĒāĄė×Ó£¬ČÜŅŗĻŌĖįŠŌ£¬ĖłŅŌĒāĄė×ÓµÄÅØ¶Č“óÓŚĒāŃõøłÅØ¶Č£¬ČÜŅŗÖŠĄė×ÓÅØ¶Č“óŠ”Ė³ŠņĪŖ£ŗc(SO42-)£¾c(NH4+)£¾c(Al3+)£¾c(H+)£¾c(OH-) ”£
¢Śmµć“¦£¬³ĮµķµÄĪļÖŹµÄĮæ²»±ä£¬·¢Éś·“Ó¦ĪŖ£ŗļ§øłĄė×ÓŗĶĒāŃõøłĄė×Ó·“Ó¦³ÉŅ»Ė®ŗĻ°±£¬ĘäĄė×Ó·½³ĢŹ½ĪŖNH4+ + OH-£½NH3”¤H2O”£
¢Ū20mL1.2 mol”¤L-1Ba(OH)2ČÜŅŗŗ¬ÓŠ0.048molOH-ŗĶ0.024molBa2+£¬10mL1mol”¤L-1RČÜŅŗÖŠŗ¬ÓŠ0.01molNH4+”¢0.01molAl3+ŗĶ0.02molSO42-£¬µ±0.048molOH-ĶźČ«·“Ó¦ĶźŹ±£¬»¹ÓŠ0.002mol Al(OH)3Ī“Čܽā£¬0.02molSO42-Óė±µĄė×Ó·“Ӧɜ³É0.02molĮņĖį±µ³Įµķ£¬ĖłŅŌ×īŗó³ĮµķµÄĪļÖŹµÄĮæĪŖ0.022mol”£
Ņņ“Ė£¬±¾ĢāÕżČ·“š°øŹĒ£ŗc(SO42-)£¾c(NH4+)£¾c(Al3+)£¾c(H+)£¾c(OH-)£»NH4+ + OH-£½NH3”¤H2O£» 0.022”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ£Ø1£©ŅŃÖŖĻĀĮŠ·“Ó¦µÄģŹ±ä
¢ŁCH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ”÷H1=-870.3kJ/mol
¢ŚC(s)+O2(g) =CO2(g) ”÷H2=-393.5kJ/mol
¢Ū2H2(g)+O2(g) =2H2O(l) ”÷H3=-285.8kJ/mol
ŹŌ¼ĘĖć·“Ó¦2C(s)+2H2(g)+O2(g) =CH3COOH(l)µÄģŹ±ä¦¤H=_____________kJ/mol”£
£Ø2£©ŹµŃé²āµĆ£¬5gŅŗĢ¬¼×“¼(CH3OH)ŌŚŃõĘųÖŠ³ä·ÖČ¼ÉÕÉś³É¶žŃõ»ÆĢ¼ĘųĢåŗĶŅŗĢ¬Ė®Ź±ŹĶ·Å³ö113£®5kJµÄČČĮ棬ŹŌŠ“³ö¼×“¼Č¼ÉÕµÄČČ»Æѧ·½³ĢŹ½:_________________________”£
£Ø3£©»š¼żĶĘ½ųĘ÷³£ŅŌĘųĢ¬ĮŖ°±£ØN2H4£©ĪŖČ¼ĮĻ”¢ŅŗĢ¬¹żŃõ»ÆĒāĪŖÖśČ¼¼Į½ųŠŠČČÄÜĢį¹©£®·“Ó¦¹ż³ĢÖŠÉś³ÉµÄĘųĢåæɲĪÓė“óĘųŃ»·”£²āµĆµ±·“Ó¦¹ż³ĢÖŠÓŠ1molĖ®ÕōĘųÉś³ÉŹ±·Å³ö161kJµÄČČĮ森ŹŌŠ“³ö·“Ó¦¹ż³ĢÖŠµÄČČ»Æѧ·½³ĢŹ½£ŗ___________________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĘĻĢŃĢĒĖįŃĒĢś[(C6H11O7)2Fe2H2O]ŹĒÖŲŅŖµÄæóĪļÖŹĢķ¼Ó¼Į£¬ĖüµÄĪüŹÕŠ§¹ū±ČĪŽ»śĢśŃĪŗĆ”£Ņ»ÖÖ¹¤ŅµÉĻÖʱøĘĻĢŃĢĒĖįŃĒĢśµÄ¹¤ŅÕĮ÷³ĢČēĻĀ£ŗ
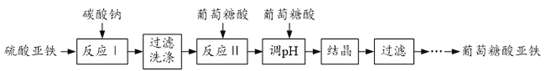
£Ø1£©·“Ó¦¢ńµÄ»Æѧ·½³ĢŹ½ĪŖ______”£
£Ø2£©¢ŁĢ¼ĖįŃĒĢś¹żĀĖŹ±ŠčŌŚ±ķĆę±£ĮōĖ®²ćµÄŌŅņŹĒ______£»
¢Ś¼ģŃéFeCO3ŅŃ¾Ļ“µÓøɾ»µÄ²Ł×÷ĪŖ______”£
£Ø3£©·“Ó¦¢ņŗó¼ÓČėĘĻĢŃĢĒĖįµ÷½ŚČÜŅŗpHÖĮ5.8£¬ĘäŌŅņŹĒ______”£
£Ø4£©ĘĻĢŃĢĒĖįŃĒĢśČÜŅŗ½į¾§”¢Ļ“µÓŹ±¾łŠč¼ÓČėŅŅ“¼£¬ĘäÄæµÄ·Ö±šŹĒ______£¬______”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”收ӊ»ś»Æѧ»ł“””·
(1) ·Ö×ÓÖŠµÄ¹ŁÄÜĶÅÓėÓŠ»ś»ÆŗĻĪļµÄŠŌÖŹĆÜĒŠĻą¹Ų”£
¢ŁĻĀĮŠ»ÆŗĻĪļÖŠÓė![]() »„ĪŖĶ¬ĻµĪļµÄŹĒ____(Ģī×ÖÄø)”£
»„ĪŖĶ¬ĻµĪļµÄŹĒ____(Ģī×ÖÄø)”£
a. ![]() b.
b. ![]() c.
c. ![]()
¢ŚĻĀĮŠ»ÆŗĻĪļÖŠ,³£ĪĀĻĀÄÜŹ¹ĖįŠŌøßĆĢĖį¼ŲČÜŅŗĶŹÉ«µÄŹĒ____(Ģī×ÖÄø)”£
a. CH3CH3 b. HC”ŌCH c. CH3COOH
¢ŪĻĀĮŠ»ÆŗĻĪļÖŠ,ÄÜ·¢Éśõ„»Æ·“Ó¦µÄŹĒ____(Ģī×ÖÄø)”£
a. CH3CH2Cl b. CH3CHO c. CH3CH2OH
(2) »ÆŗĻĪļX(![]() )ŹĒŅ»ÖÖŗĻ³ÉŅŗ¾§²ÄĮĻµÄ»Æ¹¤ŌĮĻ”£
)ŹĒŅ»ÖÖŗĻ³ÉŅŗ¾§²ÄĮĻµÄ»Æ¹¤ŌĮĻ”£
¢Ł1 mol XŌŚŅ»¶ØĢõ¼žĻĀ×ī¶ąÄÜÓė____mol H2·¢Éś¼Ó³É·“Ó¦”£
¢ŚXŌŚĖįŠŌĢõ¼žĻĀĖ®½āæÉÉś³É![]() ŗĶ________(ÓĆ½į¹¹¼ņŹ½±ķŹ¾)”£
ŗĶ________(ÓĆ½į¹¹¼ņŹ½±ķŹ¾)”£
¢Ū![]() ·Ö×ÓÖŠ×ī¶ąÓŠ____øöĢ¼Ō×Ó¹²Ę½Ćę”£
·Ö×ÓÖŠ×ī¶ąÓŠ____øöĢ¼Ō×Ó¹²Ę½Ćę”£
(3) »ÆŗĻĪļDŹĒŅ»ÖÖŅ½Ņ©ÖŠ¼äĢå,æÉĶعżĻĀĮŠ·½·ØŗĻ³É”£
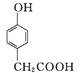 A
A![]()
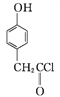 B””””
B””””![]()
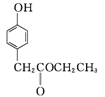 C”””””” ””””
C”””””” ””””![]()
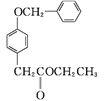 D
D
¢ŁA”śBµÄ·“Ó¦ĄąŠĶĪŖ____”£
¢ŚDÖŠŗ¬Ńõ¹ŁÄÜĶÅÓŠ____ŗĶ____(ĢīĆū³Ę)”£
¢ŪC”śDµÄ·“Ó¦ÖŠÓŠHClÉś³É,ŌņMµÄ½į¹¹¼ņŹ½ĪŖ_______”£
¢ÜEŹĒAµÄŅ»ÖÖĶ¬·ÖŅģ¹¹Ģå,E·Ö×ÓµÄŗĖ“Ź²ÕńĒāĘ×¹²ÓŠ4øöĪüŹÕ·å,ÄÜ·¢ÉśŅų¾µ·“Ó¦,ÄÜÓėFeCl3ČÜŅŗ·¢ÉśĻŌÉ«·“Ó¦”£EµÄ½į¹¹¼ņŹ½ĪŖ___________(ČĪŠ“Ņ»ÖÖ)”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖW”¢X”¢Y”¢ZĪŖ¶ĢÖÜĘŚŌŖĖŲ£¬W”¢ZĶ¬Ö÷×壬X”¢Y”¢ZĶ¬ÖÜĘŚ£¬WµÄĘųĢ¬Ēā»ÆĪļµÄĪČ¶ØŠŌ“óÓŚZµÄĘųĢ¬Ēā»ÆĪļĪČ¶ØŠŌ£¬X”¢YĪŖ½šŹōŌŖĖŲ£¬XµÄŃōĄė×ÓµÄŃõ»ÆŠŌŠ”ÓŚYµÄŃōĄė×ÓµÄŃõ»ÆŠŌ£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A. X”¢Y”¢Z”¢WµÄŌ×Ó°ė¾¶ŅĄ“Ī¼õŠ”
B. WÓėXŠĪ³ÉµÄ»ÆŗĻĪļÖŠÖ»ŗ¬Ąė×Ó¼ü
C. WµÄĘųĢ¬Ēā»ÆĪļµÄ·ŠµćŅ»¶ØøßÓŚZµÄĘųĢ¬Ēā»ÆĪļµÄ·Šµć
D. ČōWÓėYµÄŌ×ÓŠņŹżĻą²ī5£¬Ōņ¶žÕߊĪ³É»ÆŗĻĪļµÄ»ÆѧŹ½Ņ»¶ØĪŖY2W3
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĢ¼”¢µŖ”¢Ńõ”¢ĀČ”¢ÄĘ”¢ĶµČŌŖĖŲµÄ»ÆŗĻĪļ¹ć·ŗ“ęŌŚÓŚ×ŌČ»½ē£¬»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©»łĢ¬ĀČŌ×ӵļŪµē×ÓÅŲ¼Ķ¼ŹĒ________________________£»»łĢ¬ĶŌ×ÓŗĖĶāµē×ÓÕ¼ÓŠµÄæÕ¼äŌĖ¶ÆדĢ¬ÓŠ____________ÖÖ
£Ø2£©Ģ¼”¢µŖ”¢ŃõČżÖÖŌŖĖŲÖŠµŚŅ»µēĄėÄÜ×ī“óµÄŹĒ____________ (ĢīŌŖĖŲ·ūŗÅ)CO32-ÖŠĢ¼Ō×ÓµÄŌӻƹģµĄĄąŠĶĪŖ____________”£
£Ø3£©ĻąĶ¬Ģõ¼žĻĀ£¬Ė®µÄ·ŠµćøßÓŚŅŗ°±£¬ŌŅņŹĒ________________________”£
£Ø4£©ĶÓėCN”„æÉŠĪ³ÉĀēŗĻĄė×Ó[Cu(CN”„)4]2-£¬Š“³öŅ»ÖÖÓėCN”„»„ĪŖµČµē×ÓĢåµÄ·Ö×ӵĻÆѧŹ½____________£»1 mol[ Cu(CN”„)4]2-ÖŠŗ¬ÓŠ____________mol¦Ņ¼ü£»Čō½«[Cu(CN”„)4]2-ÖŠ¶žøöCN”„»»ĪŖCl”„£¬Ö»ÓŠŅ»ÖÖ½į¹¹£¬Ōņ[Cu(CN”„)4]2-ÖŠ4øöµŖŌ×ÓĖł“¦æÕ¼äĪ»ÖĆ¹ŲĻµĪŖ_________”£
£Ø5£©ĀČ»ÆÄĘµÄ¾§°ūČēĶ¼ĖłŹ¾”£¾§ĢåÖŠĀČĄė×ÓŅŌĆęŠÄĮ¢·½×īĆܶѻżÅÅĮŠ£¬ÄĘĄė×ÓĒ¶ČėŌŚĀČĄė×ÓÖ®¼äµÄæÕĻ¶ÖŠ”£Ņ»øöĀČĄė×ÓÖÜĪ§ĄėĀČĄė×Ó×ī½üµÄĀČĄė×ÓŹżÄæĪŖ__________øö”£ŅŃÖŖ£ŗ°ė¾¶r(Cl”„)=apm£¬r(Na+)=bpm”£Ä¦¶ūÖŹĮæM(NaCI)=cg”¤mol-1ŌņĀČ»ÆÄĘ¾§ĢåµÄĆܶČĪŖ_________g”¤cm-3

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ¹ŲÓŚĖµ·ØÕżČ·µÄŹĒ£Ø””””£©
A. HClŗĶNaOH·“Ó¦µÄÖŠŗĶČČ”÷H=©57.3 kJ/mol”£ŌņH2SO4ŗĶBa(OH)2·“Ó¦µÄÖŠŗĶČČ”÷H=2”Į(©57.3) kJ/mol
B. ŅŃÖŖC2H5OH(l)µÄČ¼ÉÕČČŹĒ1366.8 kJ/mol£¬ŌņC2H5OH(l)+3O2(g) ØT 2CO2(g)+3H2O(g) ·“Ó¦µÄ”÷H=£1366.8 kJ/mol
C. Ņ»¶ØĢõ¼žĻĀ2SO2(g)+O2(g)![]() 2SO3(g) ”÷H1<0£¬2SO2(g)+O2(g)
2SO3(g) ”÷H1<0£¬2SO2(g)+O2(g)![]() 2SO3(l) ”÷H2<0£¬Ōņ”÷H1£¾”÷H2
2SO3(l) ”÷H2<0£¬Ōņ”÷H1£¾”÷H2
D. ŌŚŅ»¶ØĪĀ¶ČŗĶŃ¹ĒæĻĀ£¬½«0.5mol N2ŗĶ1.5 mol H2ÖĆÓŚĆܱÕČŻĘ÷ÖŠ³ä·Ö·“Ӧɜ³ÉNH3£Øg£©£¬·Å³öČČĮæ19.3 kJ£¬ŌņĘäČČ»Æѧ·½³ĢŹ½ĪŖN2(g)+3H2(g)![]() 2NH3(g) ”÷H=©38.6kJ/mol
2NH3(g) ”÷H=©38.6kJ/mol
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”湤ŅµÉĻŅŌŅŅ“¼ĪŖŌĮĻ¾Ņ»ĻµĮŠ·“Ó¦æÉŅŌµĆµ½4ōĒ»ł±āĢŅĖįŗĶĻć¶¹ĖŲ3ōČĖį£¬¶žÕßµÄŗĻ³ÉĀ·ĻßČēĻĀ(²æ·Ö²śĪļ¼°Ģõ¼žĪ“ĮŠ³ö)£ŗ
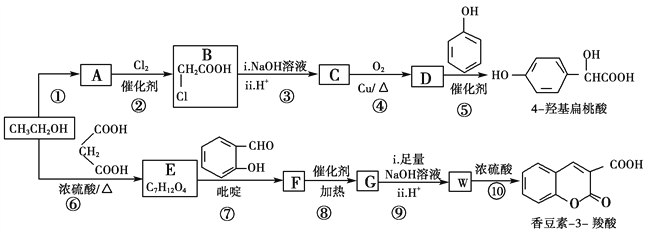
ŅŃÖŖ£ŗ
¢ń.RCOOR”䣫R”åOH![]() RCOOR”士R”äOH
RCOOR”士R”äOH
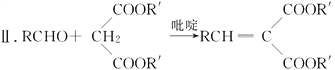
(R£¬R”䣬R”å±ķŹ¾ĒāŌ×Ó”¢Ķ黳»ņ·¼»ł)
»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©·“Ó¦¢ŚŹōÓŚČ”“ś·“Ó¦£¬ŌņAÖŠ¹ŁÄÜĶŵÄĆū³ĘŹĒ________
£Ø2£©  µÄĆū³ĘŹĒ________£¬·“Ó¦¢ŻµÄ·“Ó¦ĄąŠĶĪŖ________”£
µÄĆū³ĘŹĒ________£¬·“Ó¦¢ŻµÄ·“Ó¦ĄąŠĶĪŖ________”£
£Ø3£©·“Ó¦¢ŽµÄ»Æѧ·½³ĢŹ½ŹĒ________________________________________”£
£Ø4£©ŅŃÖŖG·Ö×ÓÖŠŗ¬ÓŠ2øöĮłŌŖ»·”£ĻĀĮŠÓŠ¹ŲĖµ·ØÕżČ·µÄŹĒ________(Ģī±źŗÅ)”£
a£®ŗĖ“Ź²ÕńŅĒæɲā³öEÓŠ5ÖÖĄąŠĶµÄĒāŌ×Ó
b£®ÖŹĘ×ŅĒæɼģ²āFµÄ×ī“óÖŹŗɱȵÄÖµĪŖ236
c£® G·Ö×ÓÖŠµÄĢ¼Ō×Ó¾łæÉŅŌ¹²Ćę
d£®»ÆŗĻĪļWÄÜ·¢Éś¼Ó¾Ū·“Ó¦µĆµ½ĻߊĶøß·Ö×Ó»ÆŗĻĪļ
£Ø5£©Ä³·¼Ļć»ÆŗĻĪļQŹĒ4ōĒ»ł±āĢŅĖįµÄĶ¬·ÖŅģ¹¹Ģ壬¾ßÓŠĻĀĮŠĢŲÕ÷£ŗ¢Ł±½»·ÉĻÖ»ÓŠ3øöČ”“ś»ł£»¢ŚÄÜ·¢ÉśĖ®½ā·“Ó¦ŗĶŅų¾µ·“Ó¦£»¢Ū1 mol Q×ī¶ąÄÜĻūŗÄ3 mol NaOH”£Q¹²ÓŠ________ÖÖ(²»ŗ¬Į¢ĢåŅģ¹¹)
£Ø6£©×ŠĻø¹Ū²ģÓÉŅŅ“¼ŗĻ³ÉĻć¶¹ĖŲ-3-ōČĖįµÄ¹ż³Ģ£¬½įŗĻĻą¹ŲŠÅĻ¢£¬µ±ŅŅ“¼Óė±ū¶žĖįµÄĪļÖŹµÄĮæµÄ±ČĪŖ_______Ź±£¬Ö»Šķ3²½¼“æÉĶź³ÉŗĻ³ÉĀ·Ļß”£ĒėŠ“³öŗĻ³ÉĀ·Ļß_______________
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æµēø”єĿ¾Ū·ØŹĒ¹¤ŅµÉĻ²ÉÓƵÄŅ»ÖÖĪŪĖ®“¦Ąķ·½·Ø£¬¼“±£³ÖĪŪĖ®µÄpHŌŚ5.0~6.0Ö®¼ä£¬Ķعżµē½āÉś³ÉFe(OH)3½ŗĢ壬Fe(OH)3½ŗĢå¾ßÓŠĪüø½×÷ÓĆ£¬æÉĪüø½Ė®ÖŠµÄĪŪĪļ¶ųŹ¹Ęä³ĮµķĻĀĄ“£¬Ęšµ½¾»Ė®µÄ×÷ÓĆ£¬ĘäŌĄķČēĶ¼ĖłŹ¾”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ

A. ŹÆÄ«µē¼«ÉĻ·¢ÉśŃõ»Æ·“Ó¦ B. Ķؼ×ĶéµÄµē¼«·“Ó¦Ź½£ŗCH4+4CO32--8e-=5CO2+2H2O
C. ĶØæÕĘųµÄµē¼«·“Ó¦Ź½ĪŖO2+4e-=2O2- D. ¼×ĶéČ¼ĮĻµē³ŲÖŠCO32-ĻņæÕĘųŅ»¼«ŅʶÆ
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com