
����Ŀ��ijͬѧ�ú������������������ƹ��壬��ȡâ����Na2SO4��10H2O������������ͼ������ʾ����ش��������⣺
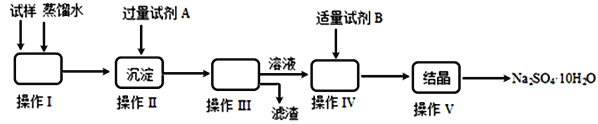
��1������I��������________������III����IJ���������________________________��
����V�IJ���������________���ñ�����룩
���� b.��ȴ c.����Ũ�� d.�������ӽ�����
��2���Լ�AΪ__________���Լ�BΪ__________�������Լ�B��Ŀ����__________________��ʵ���м��������Լ�B��ʵ�鷽��Ϊ___________________��
�ⶨ���ò�Ʒ�нᾧˮ������ʵ����̼�����������������������
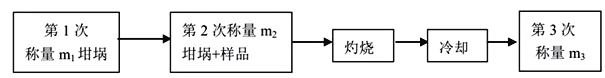
��3���������ò�Ʒ�нᾧˮ�����ı���ʽΪ___________________
��4�����в����ᵼ�½��ƫ�ߵ���______________��ѡ���ţ�
a.����δ���� b.���ȹ������о��彦ʧ c.�����к����ӷ�����
���𰸡� �ܽ� �ձ�����������©�� cba NaOH ���� ��ȥ�������м��������NaOH �ٵμ�����Ĺ����У�������pH��ֽ����pH�ƣ��ⶨ��Һ��pH���պ�Ϊ7 ![]() ab
ab
����������1��������������Ϊ�ܽ���壬���� III�ǹ��˲������ݴ�ѡ������IJ�������Ϊ���ձ�����������©����
��2������������֪AΪ����������������Һ��BΪϡ������Һ������ϡ�����ȥ���� II�м��������NaOH�����òⶨ��ҺPH�ķ����ж��Ƿ�ǡ���к�ʣ���������ƣ�ʵ���м��������Լ�B��ʵ�鷽��Ϊ���ڵμ�����Ĺ����У�������pH��ֽ����pH�ƣ��ⶨ��Һ��pH���պ�Ϊ7��
��3����Ʒ������Ϊ��m2-m1��g����Ʒ�������Ƶ�����Ϊ��m3-m1��g����ˮ������Ϊ��m2-m1��g-��m3-m1��g=��m2-m3��g�����ò�Ʒ�нᾧˮ�����ı���ʽΪ![]() ��
��
��4��a.����δ�������ƷС�����ɵ�ˮƫ�࣬�ⶨ���ƫ�ߣ���a��ȷ��b.���ȹ������о��彦ʧ���������ɵ�ˮƫ�࣬�ⶨ���ƫ�ߣ���b��ȷ�� c.�����к����ӷ����ʣ��������ɵ�ˮƫС���ⶨ���ƫ�ͣ���c����Ϊab��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Ҫ���л��ϳ��м��壬�㷺Ӧ���ڻ�ѧ��ҵ��ʵ�����Ʊ����������Ļ�ѧ����ʽ���£�CH3COOH��C2H5OH![]() CH3COOC2H5��H2O
CH3COOC2H5��H2O
��1���÷�Ӧ��ƽ�ⳣ������ʽK��____________________��
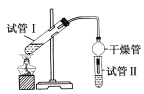
��2��Ϊ֤��Ũ�����ڸ÷�Ӧ�����˴�������ˮ�������ã�ijͬѧ������ͼ��ʾװ�ý���������4��ʵ�顣ʵ�鿪ʼ���þƾ�����3 min���ټ���ʹ֮����3 min��ʵ������������Թ����ٲ��л���ĺ�ȣ�ʵ���¼���£�
ʵ���� | �Թ������Լ� | �Թ������Լ� | ����л���ĺ��/cm |
A | 3 mL�Ҵ���2 mL���ᡢ1 mL 18 mol��L��1ŨH2SO4 | ����Na2CO3��Һ | 5.0 |
B | 3 mL�Ҵ���2 mL���� | 0.1 | |
C | 3 mL�Ҵ���2 mL���ᡢ6 mL 3 mol��L��1 H2SO4 | 1.2 | |
D | 3 mL�Ҵ���2 mL���ᡢ���� | 1.2 |
��ʵ��D��Ŀ������ʵ��C����գ�֤��H����������Ӧ���д����á�ʵ��D��Ӧ��������������Ũ�ȷֱ���____________mL��____________mol��L��1��
������ʵ��____________(��ʵ����)�����ݣ������Ʋ��ŨH2SO4����ˮ�ԣ���������������IJ��ʡ�ŨH2SO4����ˮ���ܹ���������������ʵ�ԭ����__________________��
������������������������IJ��ʣ���ʵ�鷢���¶ȹ������������IJ��ʷ������ͣ����ܵ�ԭ����______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2017Т����ģ�������д���ҩƷ�ķ����У���ȷ����( )
A��Һ�屣���ڴ������IJ���ƿ��
B��������ˮ��������ɫ���ƿ��
C������ﮱ�����ʯ������
D����������Һ�����ڴ�ĥ�ڲ������IJ���ƿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ӣ��ڼ�����Һ���ܴ������棬����ҺΪ��ɫ�����ǣ� ��
A.K+ MnO4�� Cl�� SO42��
B.Na+ Ba2+ NO3�� Cl��
C.Na+ SO42�� Cu2+ Cl��
D.Na+ H+ NO3�� SO42��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���У���ȷ����
A������Ӧ��Ũ�ȣ�ƽ�������ƶ�����Ӧ���ת����һ������
B�������淴Ӧ���ʸı�ʱ��ƽ��һ�������ƶ�
C�������κο��淴Ӧ��ʹ�ô���ֻ�ı䷴Ӧ���ʣ���Ӱ��ƽ��
D��������ϵѹǿ����ѧ��Ӧ���ʼӿ죬��ѧƽ��һ�������ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ũ��������������������棬����Ϊ�������Ũ�����з�����_______________�������ڼ��������£�Ũ���ỹ�ǿ��Ժ�����Ӧ�ġ�
д�����ڼ��������º�����Ũ���ᷴӦ�Ļ�ѧ����ʽ�����������ת�Ʒ�������Ŀ____________________________________________________��
������Ӧ��________Ԫ�ر���ԭ����ԭ������_________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2015�������ۻ�ѧ�����±�������ѧ���״���X�����⼼���۲쵽CO��O�ڴ��������γɻ�ѧ���Ĺ��̡���Ӧ���̵�ʾ��ͼ���£�

����˵������ȷ���� �� ��
A��CO��O����CO2�����ȷ�Ӧ
B���ڸù����У�CO�ϼ��γ�C��O
C��CO��O�����˾��м��Թ��ۼ���CO2
D��״̬�� ��״̬����ʾCO��O2��Ӧ�Ĺ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����֪25 ��ʱ�й�����ĵ���ƽ�ⳣ����
���ữѧʽ | HSCN | CH3COOH | HCN | H2CO3 |
����ƽ�ⳣ�� | 1.3��10-1 | 1.8��10-5 | 4.9��10-10 | K1=4.3��10-7 K2=5.6��10-11 |
�� ͬ�¶��£���pHֵ��a. NaHCO3��b. NaCN��c��Na2CO3��Һ�����ʵ���Ũ���ɴ�С��˳��Ϊ__________������ţ���
�� 25 ��ʱ����20mL 0.1mol/LCH3COOH��Һ��20mL0.1mol/LHSCN��Һ�ֱ���20ml0.1mol/L NaHCO3��Һ��ϣ�ʵ���ò������������(V)��ʱ��(t)�ı仯��ͼ��ʾ��
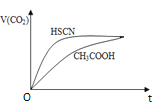
��Ӧ��ʼ��������Һ����CO2��������ʴ������Բ����ԭ���ǣ�________��Ӧ��������������Һ�У�c(SCN-)________c(CH3COO-)���> ������< ����= ��)
�� �������¶Ȳ��䣬�ڴ�����Һ�м���һ�������������������С����______������ţ���
a.c(CH3COO-�� b.c(H+) c.Kw d���������ƽ�ⳣ��
��2��úȼ�ղ���������Ҳ�������������CH4����ԭNOx�������������������Ⱦ����֪��CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ��H=-867.0kJ mol-1
2NO2(g)![]() N2O4(g) ��H=-56.9kJ mol-1
N2O4(g) ��H=-56.9kJ mol-1
H2O(g)=H2O(l) ��H=-44.0kJ mol-1
д��CH4����ԭN2O4(g������N2(g)��CO2(g)��H2O(l)���Ȼ�ѧ����ʽ_________
��3������ȼ�ϵ�ؿ����������������ʡ���ͼ�����ü���ȼ�ϵ�ص��50mL 2mol/L���Ȼ�ͭ��Һ��װ��ʾ��ͼ����ش��������⣺
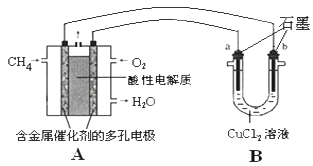
�ټ���ȼ�ϵ�صĸ�����Ӧʽ��____________
�� ��A������0.15mol����ʱ��B ��____������_______g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ϊ������ͭΪ��������������NaOH��Һ���е�⣬һ��ʱ���õ�2 mol Fe(OH)3�������˹����й�����ˮ (����)
A��3 mol B��4 mol C��5 mol D��6 mol
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com