
Ⅰ下列描述中正确的是( )
A. CS2为V形的极性分子
B.  的空间构型为平面三角形
的空间构型为平面三角形
C. SF6中有6对完全相同的成键电子对
D. SiF4和 的中心原子均为sp3杂化
的中心原子均为sp3杂化
Ⅱ.金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(1)Ni原子的核外电子排布式为__________________________________;
(2)NiO、FeO的晶体结构类型均与氯化钠的相同, 和
和 的离子半径分别为69pm和78pm,则熔点NiO_________________FeO(填“<”或“>”);
的离子半径分别为69pm和78pm,则熔点NiO_________________FeO(填“<”或“>”);
(3)NiO晶胞中Ni和O的配位数分别为_________________、_________________;
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为_________________;
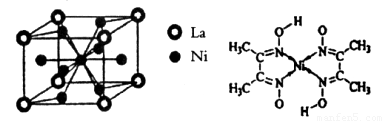
(5)丁二酮肟常用于检验 :在稀氨水介质中,丁二酮肟与
:在稀氨水介质中,丁二酮肟与 反应可生成鲜红色沉淀,其结构如右上图所示。
反应可生成鲜红色沉淀,其结构如右上图所示。
①该结构中,碳碳之间的共价键类型是σ键,碳氮之间的共价键类型是_________________。氮镍之间形成的化学键是_________________;
②该结构中,氧氢之间除共价键外还可存在_________________键;
③该结构中,碳原子的杂化轨道类型有_________________。
(20分)Ⅰ. (6分)C、D Ⅱ. (14分)(1)[Ar] (2)> (3)6,6
(2)> (3)6,6
(4) (5)①一个σ键、一个π键、配位键 ②氢键 ③sp2、sp3(每空1分)
(5)①一个σ键、一个π键、配位键 ②氢键 ③sp2、sp3(每空1分)
【解析】
试题分析:Ⅰ.CS2分子中中心原子碳原子含有的孤对电子对数=(4-2×2)÷2=0,所以该分子是直线型结构,属于含有极性键的非极性分子,A不正确;ClO3-中中心原子氯原子含有的孤对电子对数=(7+1-3×2)÷2=1,所以该微粒是三角锥形结构,B不正确;在SF6分子中,S和F形成的是极性键,6个共价键完全是相同,即有6对完全相同的成键电子对,C正确;SiF4和 的空间构型分别为正四面体和三角锥形,但中心原子均采用的是sp3杂化,D正确,答案选CD。
的空间构型分别为正四面体和三角锥形,但中心原子均采用的是sp3杂化,D正确,答案选CD。
Ⅱ.(1)Ni的原子序数是28,则根据构造原理可知,Ni原子的核外电子排布式为[Ar] 。
。
(2)Ni0、Fe0的晶体结构类型均与氯化钠的相同,说明二者都是离子晶体,离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,熔点越高.由于Ni2+的离子半径小于Fe2+的离子半径,属于熔点是NiO>FeO。
(3)因为Ni0、Fe0的晶体结构类型均与氯化钠的相同,而氯化钠中阴阳离子的配位数均为6,所以Ni0晶胞中Ni和O的配位数也均为6。
(4)根据晶胞结构,并依据均摊法可知,晶胞中镧原子数= 。镍原子数=
。镍原子数= ,所以化学式为LaNi5。
,所以化学式为LaNi5。
(5)①碳和氮形成双键,双键是由一个σ键和一个π键构成;镍原子有空轨道,氮原子有孤电子对,因此二者形成配位键。
②氧原子与氢原子之间可以形成氢键。
③在该结构中碳原子既有单键又有双键,因此杂化类型是sp2和sp3杂化。
考点:考查晶体的类型与物质的性质的相互关系及应用;原子核外电子排布;化学键;判断简单分子或离子的构型;配合物的成键情况;原子轨道杂化方式及杂化类型判断
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的应试能力和逻辑推理能力。题时注意电子排布式的书写方法,晶体熔点比较方法,分子空间构型的判断方法以及晶胞的有关计算,注意学习中有关做题方法的积累和总结。


 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com