
 ���������֪ʶ���
���������֪ʶ��� ��R������������ͬ����
��R������������ͬ����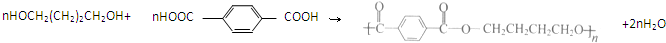 ��
��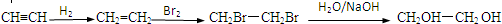 ��
�� ���� ���ݸ����ʵ�ת����ϵ����Ȳ���ȩ�����ӳɷ�Ӧ����DΪHC��CCH2OH��D���ȩ��һ�������ӳɷ�Ӧ����EΪHOCH2C��CCH2OH��E�����������ӳɷ�Ӧ����HOCH2CH2CH2CH2OH��2������Ȳ�ۺϵõ�AΪHC��CCH=CH2�������Ϣ��֪��HOCH2CH2CH2CH2OH��֪��A�����������ӳɷ�Ӧ����BΪCH2=CHCH=CH2��B���巢���ӳɷ�Ӧ����BrCH2CH=CHCH2Br��BrCH2CH=CHCH2Br�����������ӳɷ�Ӧ����CΪBrCH2CH2CH2CH2Br��C����ˮ�ⷴӦ�õ�HOCH2CH2CH2CH2OH��1��4-��������Ա������ᷢ�����۷�Ӧ����PBTΪ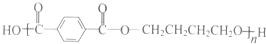 ������Ȳ���Ҷ�������������Ȳ�������ӳ�������ϩ����ϩ����ӳ�����1��2-�������飬1��2-���������ٷ�������ˮ��ɵ��Ҷ������ݴ˽��
������Ȳ���Ҷ�������������Ȳ�������ӳ�������ϩ����ϩ����ӳ�����1��2-�������飬1��2-���������ٷ�������ˮ��ɵ��Ҷ������ݴ˽��
��� �⣺���ݸ����ʵ�ת����ϵ����Ȳ���ȩ�����ӳɷ�Ӧ����DΪHC��CCH2OH��D���ȩ��һ�������ӳɷ�Ӧ����EΪHOCH2C��CCH2OH��E�����������ӳɷ�Ӧ����HOCH2CH2CH2CH2OH��2������Ȳ�ۺϵõ�AΪHC��CCH=CH2�������Ϣ��֪��HOCH2CH2CH2CH2OH��֪��A�����������ӳɷ�Ӧ����BΪCH2=CHCH=CH2��B���巢���ӳɷ�Ӧ����BrCH2CH=CHCH2Br��BrCH2CH=CHCH2Br�����������ӳɷ�Ӧ����CΪBrCH2CH2CH2CH2Br��C����ˮ�ⷴӦ�õ�HOCH2CH2CH2CH2OH��1��4-��������Ա������ᷢ�����۷�Ӧ����PBTΪ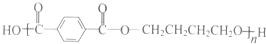 ��
��
��1����������ķ�����֪��AΪHC��CCH=CH2��DΪHC��CCH2OH��
�ʴ�Ϊ��HC��CCH=CH2��HC��CCH2OH��
��2��CH2=CHCH=CH2���巢��1��4-�ӳɣ�����CH2BrCH=CHCH2Br�Ļ�ѧ��Ӧ����ʽΪCH2=CHCH=CH2+Br2��CH2BrCH=CHCH2Br��1��4-��������Ա������ᷢ�����۷�Ӧ����PBTΪ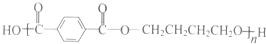 �Ļ�ѧ��Ӧ����ʽΪ��
�Ļ�ѧ��Ӧ����ʽΪ��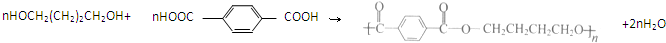 ��
��
�ʴ�Ϊ��CH2=CHCH=CH2+Br2��CH2BrCH=CHCH2Br��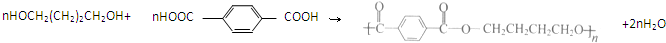 ��
��
��3�����ڶԱ�������Ľṹ����ͬһֱ���ϵ�ԭ��Ϊ���ڱ�����λ�ϵ�����̼��������ԭ�ӣ����������4����
�ʴ�Ϊ��4��
��4������Ȳ���Ҷ�������������Ȳ�������ӳ�������ϩ����ϩ����ӳ�����1��2-�������飬1��2-���������ٷ�������ˮ��ɵ��Ҷ�������Ӧ�ĺϳ�·��Ϊ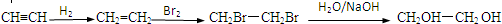 ��
��
�ʴ�Ϊ��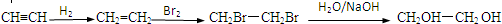 ��
��
���� ���⿼���л����ƶ���ϳɣ�������Ȳ��Ϸ�Ӧ��Ϣ��HOCH2CH2CH2CH2OH�����ƶϣ���Ҫѧ���Ը������Ϣ�������ã��ϺõĿ���ѧ����ѧ�������Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | PH=12����Һ��NH4+��Na+��Cl-��HCO3- | |
| B�� | ��ʹpH��ֽ���ɫ����Һ��Na+��Al3+��NO3-��SO42- | |
| C�� | ���д���Fe3+����Һ��SCN-��I-��K+��Br- | |
| D�� | ����������ɫ��Һ��ClO-��MnO4-��Al3+��SO42- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | m=4 R2+�ǻ�ԭ�� | B�� | m=n R3+���������� | ||
| C�� | m=2 R2+�������� | D�� | m=y R3+�ǻ�ԭ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ��������Cl2 | |
| B�� | �������뻹ԭ�������ʵ���֮��Ϊ3��8 | |
| C�� | ÿ����1molN2��ת��3mol���� | |
| D�� | ��������δ��������NH3���ʵ���֮��Ϊ1��3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2Na2O2+2Mn2O7��4NaMnO4+O2�� | B�� | 2Na2O2+P2O3��Na4P2O7 | ||
| C�� | 2Na2O2+2 N2O3��NaNO2+O2�� | D�� | 2 Na2O2+2 N2O5��4NaNO3+O2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
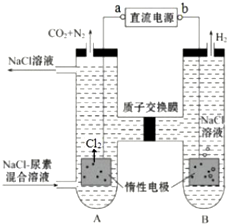 ���ڹ�����ռ����Ҫ��λ�����й㷺����;��
���ڹ�����ռ����Ҫ��λ�����й㷺����;��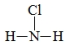 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
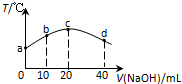 �����£�����20mL 0.01mol•L-1 HNO2�����ᣩ��Һ����μ���һ��Ũ�ȵ��ռ���Һ����û����Һ���¶ȱ仯��ͼ��ʾ�������й�˵������ȷ���ǣ�������
�����£�����20mL 0.01mol•L-1 HNO2�����ᣩ��Һ����μ���һ��Ũ�ȵ��ռ���Һ����û����Һ���¶ȱ仯��ͼ��ʾ�������й�˵������ȷ���ǣ�������| A�� | HNO2�ĵ���ƽ�ⳣ����c�㣾b�� | |
| B�� | �����ռ���ҺPH=12��c��ˮ�����ӻ�����KW=10-14 | |
| C�� | c������Һ�У�c��OH-����c��HNO2�� | |
| D�� | d������Һ�У�c��Na+����c��OH-����c��NO2-����c��H+�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ʵ����������ʵ����� | |
| B�� | ������Ħ������Ϊ32g | |
| C�� | Ħ���ǹ��ʵ�λ�Ƶ��ߴ����������֮һ | |
| D�� | ͬ��ͬѹ�£���������ͬ���κ����������ͬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���� | B�� | �ƾ� | C�� | ���Ȼ�̼ | D�� | ʯ���� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com