
一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为CH3CH2OH-4e-+H2O=CH3COOH+4H+。下列有关说法正确的是
A.正极上发生的反应是:O2+4e-+2H2O=4OH-
B.该电池反应的化学方程式为:CH3CH2OH+3O2点燃2CO2+3H2O
C.检测时,电解质溶液中的H+向正极移动
D. 若有0.4mol电子转移,则在标准状况下消耗4.48L氧气
C
【解析】
试题分析: A.由负极可知电解池溶液呈酸性,则燃料电池中,氧气在正极得电子被还原生成水,正极反应式为O2+4e-+4H+=2H2O,故A错误;B.酸性乙醇燃料电池的负极反应为CH3CH2OH-4e-+H2O=CH3COOH+4H+,可知乙醇被氧化生成乙酸和水,总反应式为CH3CH2OH+O2=CH3COOH+H2O,但反应条件下不是燃烧,故B错误;C.原电池中,阳离子向正极移动,故C正确;D.氧气得电子被还原,化合价由0价降低到-2价,若有0.4mol电子转移,则应有0.1mol氧气被还原,在标准状况下的体积为2.24L,故D错误;故选C。
考点:考查原电池的工作原理。


科目:高中化学 来源:2013-2014湖南师大附中第二学期期中考试高二化学试卷(解析版) 题型:选择题
CaC2和ZnC2、Al4C3、Mg2C3、Li2C2等都属于离子型碳化物。请通过CaC2制C2H2的反应进行思考,从中得到必要的启示,判断下列反应产物正确的是
A.ZnC2水解生成乙烷B.Al4C3水解生成丙炔
C.Mg2C3水解生成丙炔 D.Li2C2水解生成乙烯
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省黄石市秋季高二化学期中统考试卷(解析版) 题型:选择题
一定温度下,某密闭容器里发生如下反应:CO(g)+H2O(g)  CO2(g)+H2(g) (正反应为放热反应),当反应达到平衡时,测得容器中各物质的物质的量均为 n mol。欲使H2的物质的量浓度增大1倍,在其他条件不变时,下列措施可采用的是( )
CO2(g)+H2(g) (正反应为放热反应),当反应达到平衡时,测得容器中各物质的物质的量均为 n mol。欲使H2的物质的量浓度增大1倍,在其他条件不变时,下列措施可采用的是( )
①升高温度 ②增大压强
③再通入n mol CO2和n mol H2 ④再加入2n mol CO和2n mol H2O(g)
A.①② B.②④ C.③④ D.①②③
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省高三5月模拟考试理综化学试卷(解析版) 题型:选择题
乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2+O2→2CH3CHO。下列有关说法正确的是:

A.该电池为可充电池
B.每有0.1molO2反应,则迁移0.4mol
C.正极反应式为:CH2=CH2-2e-+2OH-=CH3CHO+H2O
D.电子移动方向:电极a→磷酸溶液 →电极b
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省高一下学期期中联考化学试卷(解析版) 题型:填空题
(8分)(1)某温度时,在2 L密闭容器中,X、Y、Z三种物质的物质的量随时间变化曲线如下图所示。由图中数据分析,该反应的化学方程式为:____________________________
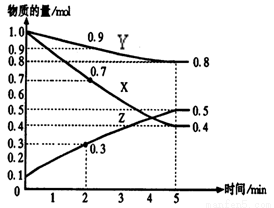
(2) 用Z表示从0—2min内该反应的平均反应速率为
____________________
(3) 某时刻t(t﹤5min)测得Y、Z两者的物质的量之比为
3:1,则X的转化率为_________
(4) 该条件下,能说明反应已达到平衡状态的是
a.容器内z物质的量浓度为0.25mol/L
b.正反应和逆反应的速率都为0
c.容器内X、Y、Z物质的量之比为1∶3∶2
d.容器内X气体的体积分数不变
e. 单位时间内消耗3a mol X,同时生成2a mol Z
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省高一下学期期中联考化学试卷(解析版) 题型:选择题
下图就是一个用废旧材料制作的可用于驱动玩具的电池的示意图。当电池工作时,下列有关说法正确的是
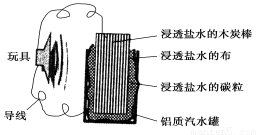
A.电池的能量转化率可达100%
B.铝罐是电池的负极
C.炭棒应与玩具电机的负极相连
D.电池工作一段时间后炭棒和碳粒的质量会减轻
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省高一下学期期中联考化学试卷(解析版) 题型:选择题
最近,意大利科学家使用普通氧分子和带正电荷的氧离子制造出了由4个氧原子构成的氧分子O4,并用质谱仪探测到了它存在的证据。下列说法正确的是
A.O4是氧元素的一种同位素
B.O4可能含有极性键
C.同温同压下,等体积的O4气体和O2含有相同的分子数
D.O4转化O2为物理变化
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省武汉外国语学校高一下学期期中考试化学试卷(解析版) 题型:实验题
(14分)
某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
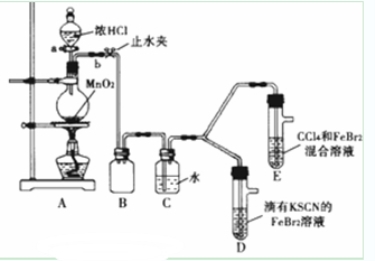
(1)①检查气体发生装置A的气密性的操作是:____________
②整套实验装置存在一处明显不足,请指出_____________.
(2)用改正后的装置进行实验.实验过程如下:
实验操作 | 实验现象 | 结论 |
打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯 | D装置中:溶液变红 E装置中:水层溶液变黄振荡后CCl4层无明显变化 | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: ______________________ |
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化:
D装置中:红色慢慢褪去。E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深最后变成红色。为探究上述实验现象的本质,小组同学查得资料如下:
Ⅰ.(SCN)2性质与卤素单质类似.氧化性:Cl2>(SCN)2. Ⅱ.Cl2和Br2反应生成BrCl,它呈红色(略带黄色),沸点为5℃,与水发生水解反应. Ⅲ.AgClO、AgBrO均可溶于水. |
①请用平衡移动原理(结合化学用语)解释Cl2过量时D中溶液红色褪去的原因___________________,请设计简单实验证明上述解释:______________________
②欲探究E中颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生.请结合化学用语解释仅产生白色沉淀的原因_______________________________________________
③将少量BrCl通入到碘化钾溶液中,该反应的化学方程式为:___________________
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省大冶市春季期末考试高二化学试卷(解析版) 题型:选择题
某固体混合物可能由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3中的一种或几种组成,现对该混合物做如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):

下列说法正确的是( )
A.固体混合物中一定含有Al,但质量不可确定 B.固体混合物中可能含有MgCl2和AlCl3
C.固体混合物中一定含有MgCl2和FeCl2 D.固体混合物中一定含有 (NH4)2SO4、MgCl2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com