
【题目】如图所示各为元素周期表的一部分,表中数字是原子序数,其中X为35的是( )
A.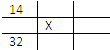
B.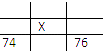
C.![]()
D.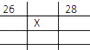
科目:高中化学 来源: 题型:
【题目】请完成下列物质的分离提纯问题。
Ⅰ.现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂除去溶液中的NaCl和Na2SO4,从而得到纯净的NaNO3溶液。相应的实验过程可用下图表示:
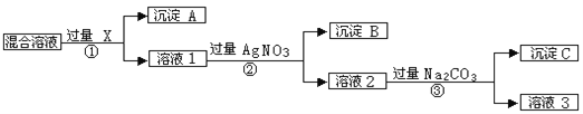
请回答下列问题:
(1)写出实验流程中下列物质的化学式:试剂X_______。
(2)证明AgNO3溶液加过量的实验方是_____________________________________________ 。(3)按此实验方案得到的溶液3中肯定含有__________(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的___________(填化学式),之后若要获得固体NaNO3需进行的实验操作是___________(填操作名称)。
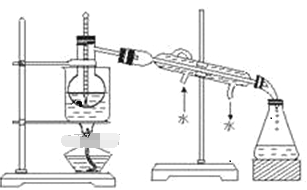
Ⅱ.某同学欲用CCl4萃取较高浓度的碘水中的碘,操作过程可以分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50ml碘水和15mlCCl4加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口的玻璃塞是否漏液;
D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正
E.旋开活塞,用烧杯接收溶液;
F.从分液漏斗上口倒出上层液体;
G.将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;
H.静置、分层。
(1)萃取过程正确操作步骤的顺序是:_________________________________ (填编号字母)。
(2)从含碘的CCl4溶液中提取碘 和回收CCl4,还需要经过蒸馏,观察下图所示实验装置指出其错误有______ 处。
(3)进行上述蒸馏操作时,最后晶态碘在____________(填仪器名称)里聚集。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2 mol SO2和1 mol O2充入一容积固定的密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g) ![]() 2SO3(g),下列物理量不再改变时,并不能说明化学反应已达到平衡状态的是( )
2SO3(g),下列物理量不再改变时,并不能说明化学反应已达到平衡状态的是( )
A. 混合气体的密度
B. 混合气体的压强
C. 混合气体的总物质的量
D. 混合气体的平均相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】居里夫人发现的镭是主族元素,它的最外层电子数是2个,共有7个电子层。下列关于它的描述错误的是
A.在化合物中呈+2价B.氢氧化物呈两性
C.单质与水反应能放出氢气D.碳酸盐难溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在能源、环保等方面有着广泛的用途,高铁酸钾在异丙醇中溶解度非常小。湿法、干法制备高铁酸盐的原理如下表所示。
湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如图所示:

①洗涤粗品时选用异丙醇而不用水的理由是__________________________________。
②反应Ⅱ的离子方程式为__________________________________________________。
③已知25 ℃时Fe(OH)3的Ksp=4.0×10-38,反应Ⅱ后的溶液中c(Fe3+)=4.0×10-5 mol/L,则需要调整pH=_______ 时,开始生成Fe(OH)3(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾,析出后溶液中c(K+)<c(Na+)。由以上信息可知______(填字母)。
A.高铁酸钾的溶解度比高铁酸钠大 B.Ksp(K2FeO4)<Ksp(Na2FeO4)
(3)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为__________________。
(4) 锌-锰碱性电池以KOH溶液为电解液,电池总反应式为:
Zn(s)+2MnO2(s)+2H2O(l)═Zn(OH)2(s)+2MnOOH(s)。
Zn--K2FeO4 也可以组成碱性电池,与 Zn--MnO2电池类似。K2FeO4在电池中作正极材料,其电极反应式为__________________________________________________________,该电池总反应的离子方程式为___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数为1-18号的元素中,下列叙述正确的是
A.I A族都是金属元素
B.II A族都是金属元素
C.最外层只有2个电子的元素一定是金属元素
D.核电荷数为17的元素的原子在化学反应中容易失去1个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.金刚石和石墨是同种物质 B.C60和CO2均是碳元素的化合物
C.石墨和C60是碳元素的同素异形体 D.O3和C60同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示自然界中的氮循环,相关说法正确的是
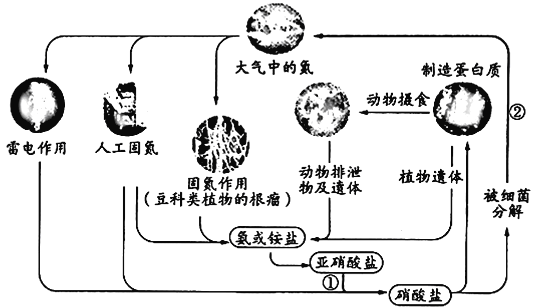
A. “雷电作用”中发生的反应是:N2+ 2O2![]() 2NO2
2NO2
B. “人工固氮”过程中,氮元素一定被还原
C. ①中涉及的反应可能有:2NO2-+O2 = 2NO3-
D. ②中涉及的反应可能有:2NO3-+12H+ = N2+ 6H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com