
| A. | 硬度:Li>Na>K | |
| B. | 熔点:金刚石>晶体硅>二氧化硅>碳化硅 | |
| C. | 第一电离能:Na<Mg<Al | |
| D. | 空间利用率:六方密堆<面心立方<体心立方 |
分析 A.碱金属元素中,其硬度随着原子序数的增大而减小;
B.原子晶体中,键长越长其键能越小,则晶体的熔点越低,分子晶体熔沸点较低;
C.同一周期,元素第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于相邻元素;
D.空间利用率:六方密堆积52%、面心立方74%、体心立方68%.
解答 解:A.碱金属元素中,其硬度随着原子序数的增大而减小,所以硬度Li>Na>K,故A正确;
B.原子晶体中,键长越长其键能越小,则晶体的熔点越低,键能大小顺序是:C-C键、C-Si键、Si-Si键,所以熔点高低顺序是:金刚石>碳化硅>晶体硅>二氧化硅,故B错误;
C.同一周期,元素第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于相邻元素,第一电离能:Mg>Al>Na,故C错误;
D.空间利用率:六方密堆积52%、面心立方74%、体心立方68%,所以空间利用率:面心立方>体心立方>六方密堆积,故D错误;
故选A.
点评 本题考查了电离能、熔点、空间利用率等知识点,侧重选修三物质结构与性质的考查,把握元素周期律、熔点高低的影响因素、空间利用率大小等为解答的关键,注意第一电离能规律中的异常现象,并会解释异常现象的原因为易错点,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ④③②① | B. | ①②③④ | C. | ③①②④ | D. | ③②①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、C1-、CO32-、K+ | B. | K+、OH-、HCO${\;}_{3}^{-}$、Na+ | ||
| C. | H+、Fe2+、MnO4-、Cl- | D. | Ca2+、HCO${\;}_{3}^{-}$、C1-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SO4=2Na++SO4-2 | B. | Ba(OH)2=Ba2++OH2- | ||
| C. | Fe2(SO4)3=2Fe3++3SO42- | D. | Ca(NO3)2=Ca2++2(NO3)- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | O=O | H-O |
| 键能kJ.mol-1 | 436 | 496 | 463 |
| 化学键 | 填“吸收热量” 或“放出热量” | 能量变化kJ | |
拆开化学键 | 2molH2和1molO2中的化学键 | ||
| 形成化学键 | 4molH-O键 | ||
| 总能量变化 | |||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
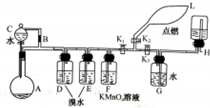 有一同学准备用Al4C3(含少量Mg2C3杂质)制取某种气种X(其装置图如图所示,夹持装置略),并进行以下实验项目:
有一同学准备用Al4C3(含少量Mg2C3杂质)制取某种气种X(其装置图如图所示,夹持装置略),并进行以下实验项目:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com