
(9��)��1�������£���0.1mol/L�İ�ˮ��0.1mol/L������������Һ���ش��������⣺
��pH ֵ:��ˮ �������ƣ��<�� ����=�� �� ��>����
�����ּ���Һ���������ᷴӦ�����Σ����������������Һ���Ũ�ȵ�������Һǡ�÷�Ӧ�����ԣ� ���ĵ�����ࡣ��Ӧ���ɵ��Ȼ����Һ�� ������ԡ� �������ԡ� �� �����ԡ�������ԭ���ǣ������ӷ���ʽ��ʾ��
����ˮ��Һ�м���һ������������Һ���������Һ��pH=7ʱ����Һ�����ӵ�Ũ�ȴ�СΪ
��ѡ����ĸ����ͬ�����������Һ��pH>7ʱ����Һ�����ӵ�Ũ�ȴ�СΪ ��
a��c(NH4+)��c(Cl��)��c(OH��)��c(H+) b��c(NH4+) = c(Cl��)��c(OH��) =c(H+)
c��c(Cl��)��c(NH4+)��c(H+)��c(OH��) d��c(NH4+)��c(Cl��)��c(H+)��c(OH��)
��2����ʢ�У�����0.��mol/L��gCl����Һ���Թ��еμ�2��2mol/L KOH��Һ���а�ɫ�������ɣ��ٵμ�2��0.1mol/L FeCl3��Һ�����á����Թ۲쵽�������� �������������ԭ���ǣ������ӷ���ʽ�ͼ�Ҫ���ֱ��
(1)��< �� NaOH ����
NH4++H2O NH3.H2O+H+
�� b a
NH3.H2O+H+
�� b a
(2)��ɫ����ת��Ϊ���ɫ 3Mg(OH)2 + 2Fe3+ = 2Fe(OH)3 + 3Mg2+ ,��ͬ������Fe(OH)3 �ܽ��С�� Mg(OH)2�ܽ�� ��ʹ Mg(OH)2�ܽ�ƽ���ƶ������ɸ�����Fe(OH)3��
����������1����ˮ���������������ǿ���Ũ����ȵ������£���ˮ�ļ��������������Ƶġ�������ǡ�÷�Ӧ�����ɵ��Ȼ��ˮ�������ԣ����Ȼ��Ʋ�ˮ�⣬�����ԡ���Һ��pH=7����c(OH��) =c(H+)�����ݵ���غ�c(NH4+)�� c(H+)= c(Cl��)��c(OH��)��֪c(NH4+) = c(Cl��)����ѡ��b��ȷ������Һ��pH>7����c(OH��) ��c(H+)��ѡ��a��ȷ��
��2����Ϊ������þ���ܽ�ȴ������������ģ����ݳ���ת����ԭ����֪��������þ��ת��Ϊ�����ܵ�����������


 ѧϰʵ����ϵ�д�
ѧϰʵ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
(9��)��1�������£���0.1mol/L�İ�ˮ��0.1mol/L������������Һ���ش��������⣺
��pH ֵ:��ˮ �������ƣ��<�� ����=�� �� ��>����
�����ּ���Һ���������ᷴӦ�����Σ����������������Һ���Ũ�ȵ�������Һǡ�÷�Ӧ�����ԣ� ���ĵ�����ࡣ��Ӧ���ɵ��Ȼ����Һ�� ������ԡ� �������ԡ� �� �����ԡ�������ԭ���ǣ������ӷ���ʽ��ʾ��
����ˮ��Һ�м���һ������������Һ���������Һ��pH=7ʱ����Һ�����ӵ�Ũ�ȴ�СΪ
��ѡ����ĸ����ͬ�����������Һ��pH>7ʱ����Һ�����ӵ�Ũ�ȴ�СΪ ��
a��c(NH4+)��c(Cl��)��c(OH��)��c(H+) b��c(NH4+) = c(Cl��)��c(OH��) =c(H+)
c��c(Cl��)��c(NH4+)��c(H+)��c(OH��) d��c(NH4+)��c(Cl��)��c(H+)��c(OH��)
��2����ʢ�У�����0.��mol/L��gCl����Һ���Թ��еμ�2��2mol/L KOH��Һ���а�ɫ�������ɣ��ٵμ�2��0.1mol/LFeCl3��Һ�����á����Թ۲쵽�������� �������������ԭ���ǣ������ӷ���ʽ�ͼ�Ҫ���ֱ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012���Ϻ����ֶ�����������ѧ��4��������⻯ѧ�Ծ����������� ���ͣ������
�����16�֣����λ�����Ⱦ�ǵ�ǰ������������Ҫ�о�����֮һ����������͵��������Ǵ�������Ҫ��Ⱦ�
1����1.5 mol SO2������������Һ��ʯ�Ҽ���������������Ԫ�ز���ʧ�������Ͽɵõ�_________________gʯ�ࣨCaSO4?2H2O����
2����CH4����NOx��Ⱦ�Ļ�ѧ����ʽΪ��
CH4��4NO �� 2N2��CO2��2H2O�� CH4��2NO2 �� N2��CO2��2H2O
����11.2 L NO2��NO�Ļ������NOx�����仹ԭΪN2����Ҫ4.48 L ��CH4������������NO2��NO�����ʵ����ֱ�Ϊ___________________����������ѻ���Ϊ��״����
3����1������������ȱλ����пZnFe2Oy��������NOx��Ⱦ��ʹNOxת��ΪN2��ͬʱZnFe2Oyת��ΪZnFe2O4����2 mol ZnFe2Oy������NO2������0.5 mol N2����y��_______________��
��2����ȱλ����пZnFe2Oz��ѧʽ����������ʽΪaZnO?bFeO?cFe2O3����֪1 mol ZnFe2Oz�����ʹ4.0 L�������NO1.4ת��ΪN2����������������ʽ�Ļ�ѧʽ�ɾ����ʾΪ______________________________��
4�����³�����������������������ͬʱ���������еĵ�������Ͷ�������Ӧԭ���ǽ�NOx������N2O5��ͨ��ϴ���γ������Σ����������γ������Ρ�����Ҫ��Ӧ���£�
NO��O3 �� NO2��O2 ������������������������������������
2NO2��O3 �� N2O5��O2 ����������������������������������
N2O5��2NH3��H2O �� 2NH4NO3 ��������������������������
SO2��O3��2NH3��H2O �� (NH4)2SO4��O2 ������������������
ij�ȵ糧������ƽ����NOx 4.5�롢SO2 9.0��(�������)��ѹ��������������������ɳ�������������O3Ũ��Ϊ90 L/m3�������������ʪ������������Ϸ�Ӧ����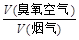 ������Ϊy����ͨ�������г�y��x�Ĺ�ϵʽ��
������Ϊy����ͨ�������г�y��x�Ĺ�ϵʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ���Ĵ�ʡ������ѧ�߶���ѧ�����п��Ի�ѧ�Ծ� ���������� ���ͣ������
(9��)��1�������£���0.1mol/L�İ�ˮ��0.1mol/L������������Һ���ش��������⣺
��pH ֵ:��ˮ �������ƣ��<�� ����="��" �� ��>����
�����ּ���Һ���������ᷴӦ�����Σ����������������Һ���Ũ�ȵ�������Һǡ�÷�Ӧ�����ԣ� ���ĵ�����ࡣ��Ӧ���ɵ��Ȼ����Һ�� ������ԡ� �������ԡ� �� �����ԡ�������ԭ���ǣ������ӷ���ʽ��ʾ��
����ˮ��Һ�м���һ������������Һ���������Һ��pH=7ʱ����Һ�����ӵ�Ũ�ȴ�СΪ
��ѡ����ĸ����ͬ�����������Һ��pH>7ʱ����Һ�����ӵ�Ũ�ȴ�СΪ ��
a��c(NH4+)��c(Cl��)��c(OH��)��c(H+) b��c(NH4+) = c(Cl��)��c(OH��) =c(H+)
c��c(Cl��)��c(NH4+)��c(H+)��c(OH��) d��c(NH4+)��c(Cl��)��c(H+)��c(OH��)
��2����ʢ�У�����0.��mol/L��gCl����Һ���Թ��еμ�2��2mol/L KOH��Һ���а�ɫ�������ɣ��ٵμ�2��0.1mol/L FeCl3��Һ�����á����Թ۲쵽�������� �������������ԭ���ǣ������ӷ���ʽ�ͼ�Ҫ���ֱ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ��ɽ��ʡ�����и�����ѧ����ĩģ�⻯ѧ�Ծ��������棩 ���ͣ������
(14��)
��1�������±��и�����Ų����ɣ����˹����Ų���22��ӦΪ ��
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
C2H4 |
C2H6 |
C2H6O |
C2H4O2 |
C3H6 |
C3H8 |
C3H8O |
C3H6O2 |
C4H8 |
C4H10 |
��2�����з�Ӧ������ȡ����Ӧ���� ��������ţ�
����ϩʹ���Ը��������Һ��ɫ �ڼ����������Ϲ��� �۱�ʹ��ˮ����ɫ
��������Ҵ���Ӧ ���Ҵ������ȩ �������Ƿ���������Ӧ
��A��B��C��D��E��FΪԭ������������������ֶ�����Ԫ�ء������£�����Ԫ�صij�������������Ϊ���壬����Ϊ���塣A��E��D��F�ֱ�ͬ���壬A����B��C��D�ֱ��γɵ�������ȵ����ַ��ӣ�C��D������������֮����E�ĺ������������ȡ��Իش��������⣺
��1��д������Ԫ�ص�Ԫ�ط��ţ� C ��F ��
��2������ʽΪA2B2D4�Ļ������뺬�����ʵ�����KOH����Һ��Ӧ��������Һ�����ԣ���ԭ���� �����÷���ʽ����Ҫ������˵����������Һ�и�����Ũ���ɴ�С��˳��Ϊ ��
��3����A��C��D��F��Fe����Ԫ�ؿ�������������Ļ�����Z����Է�������Ϊ392����1molZ�к���6mol�ᾧˮ���Ի�����Z��������ʵ�飺
a��ȡZ����Һ�����������NaOHŨ��Һ�����ȣ�������ɫ��������ɫ�д̼�����ζ�����塣��ɫ����Ѹ�ٱ�Ϊ����ɫ�����ձ�Ϊ���ɫ��
b����ȡZ����Һ�����������BaCl2��Һ������ɫ������������������ܽ⡣
��Z�Ļ�ѧʽΪ ��
����֪100mL1mol/LZ��Һ����20mL1mol/LKMnO4��Һ�������ữ��ǡ�÷�Ӧ��д���÷�Ӧ�����ӷ���ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ���Ϻ����ֶ�����������ѧ��4��������⻯ѧ�Ծ��������棩 ���ͣ������
�����16�֣����λ�����Ⱦ�ǵ�ǰ������������Ҫ�о�����֮һ����������͵��������Ǵ�������Ҫ��Ⱦ�
1����1.5 mol SO2������������Һ��ʯ�Ҽ���������������Ԫ�ز���ʧ�������Ͽɵõ�_________________gʯ�ࣨCaSO4•2H2O����
2����CH4����NOx��Ⱦ�Ļ�ѧ����ʽΪ��
CH4��4NO �� 2N2��CO2��2H2O�� CH4��2NO2 �� N2��CO2��2H2O
����11.2 L NO2��NO�Ļ������NOx�����仹ԭΪN2����Ҫ4.48 L ��CH4������������NO2��NO�����ʵ����ֱ�Ϊ___________________����������ѻ���Ϊ��״����
3����1������������ȱλ����пZnFe2Oy��������NOx��Ⱦ��ʹNOxת��ΪN2��ͬʱZnFe2Oyת��ΪZnFe2O4����2 mol ZnFe2Oy������NO2������0.5 mol N2����y��_______________��
��2����ȱλ����пZnFe2Oz��ѧʽ����������ʽΪaZnO•bFeO•cFe2O3����֪1 mol ZnFe2Oz�����ʹ4.0 L�������NO1.4ת��ΪN2����������������ʽ�Ļ�ѧʽ�ɾ����ʾΪ______________________________��
4�����³�����������������������ͬʱ���������еĵ�������Ͷ�������Ӧԭ���ǽ�NOx������N2O5��ͨ��ϴ���γ������Σ����������γ������Ρ�����Ҫ��Ӧ���£�
NO��O3 �� NO2��O2 ������������������������������������
2NO2��O3 �� N2O5��O2 ����������������������������������
N2O5��2NH3��H2O �� 2NH4NO3 ��������������������������
SO2��O3��2NH3��H2O �� (NH4)2SO4��O2 ������������������
ij�ȵ糧������ƽ����NOx 4.5�롢SO2
9.0��(�������)��ѹ��������������������ɳ�������������O3Ũ��Ϊ90 L/m3�������������ʪ������������Ϸ�Ӧ���� ������Ϊy����ͨ�������г�y��x�Ĺ�ϵʽ��
������Ϊy����ͨ�������г�y��x�Ĺ�ϵʽ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com