
| A. | H2O | B. | PH3 | C. | HF | D. | NH3 |
科目:高中化学 来源: 题型:解答题
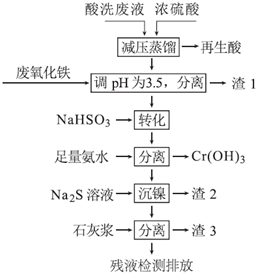
| Fe3+ | Ni2+ | Cr3+ | |
| 开始沉淀 | 1.5 | 6.7 | 4.0 |
| 沉淀完全 | 3.4 | 9.5 | 6.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | a、b、c的简单离子中,b的离子半径最大 | |
| B. | c、d、f最高价氧化物对应的水化物两两之间均可发生反应 | |
| C. | e的氢化物比f的氢化物的稳定性高 | |
| D. | 离子半径a3-小于d3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CO2 | B. | COCl2 | C. | C2H6O | D. | H2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 标准状况下,22.4LH2的分子数为1NA | |
| B. | 0 5mol•L-1的MgCl2溶液,含有Cl数为1NA | |
| C. | 56g铁片投人足量的浓硫酸中生成1.5NA个SO2分子 | |
| D. | 常温常压下,14gN2含有分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验步骤 | 预期现象和结论 | |
| ① | 取样品于试管中,加入适量2.0mol•L-1盐酸溶解后,再将产生的气体经蒸馏水、四氯化碳后导入澄清石灰水中 | a.若澄清石灰水未见浑浊,则假设1成立 b.若澄清石灰水变浑浊,则假设2或3成立 |
| ② | 取样品于试管中,加入适量2.0mol•L-1盐酸溶解后,再向试管中滴入1-2滴品红溶液,振荡 | 若品红褪色,结合实验①中的现象和结论b,则假设3 成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
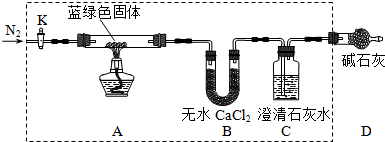
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com