

| 名称 | 相对分子质量 | 颜色,状态 | 沸点(℃) | 密度(g•cm-3) |
| 苯甲酸* | 122 | 无色片状晶体 | 249 | 1.2659 |
| 苯甲酸乙酯 | 150 | 无色澄清液体 | 212.6 | 1.05 |
| 乙醇 | 46 | 无色澄清液体 | 78.3 | 0.7893 |
| 环己烷 | 84 | 无色澄清液体 | 80.8 | 0.7318 |
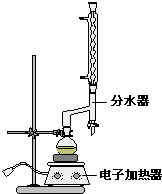
分析 (1)加入圆底烧瓶中液体的体积大约为21mL,而烧瓶所能盛放溶液的体积不超过烧瓶体积的$\frac{2}{3}$,据此判断圆底烧瓶的规格;
(2)给混合液体加热时容易发生暴沸现象,需要加入沸石防止爆沸;如果发现忘记加沸石,需要等烧瓶冷却后再补加;
(3)酯化反应为可逆反应,使用分水器不断分离除去水,可以使化学平衡向着正向移动,提高了转化率;
(4)若加入的碳酸钠不足,则产品中存在苯甲酸,而苯甲酸在100℃会迅速升华;
(5)分液漏斗有旋塞,避免分液漏斗滤液,使用前必须检查是否漏水;
(6)根据反应 及苯甲酸的量计算出理论上生成苯甲酸乙酯的质量,然后计算出产率.
及苯甲酸的量计算出理论上生成苯甲酸乙酯的质量,然后计算出产率.
解答 解:(1)烧瓶所能盛放溶液的体积不超过烧瓶体积的$\frac{2}{3}$,现在加入圆底烧瓶中液体的体积大约为21mL,所以选取烧瓶的体积应该为50mL,
故答案为:B;
(2)给混合液体加热时容易发生暴沸现象,步骤①加入沸石的作用是防止爆沸;如果加热一段时间后发现忘记加沸石,则应等烧瓶冷却后再补加,以免发生危险,
故答案为:防止爆沸;冷却后补加;
(3)反应 为可逆反应,生成物中有水生成,步骤①中使用分水器不断分离除去水,可以使生成物的浓度减小,化学平衡向着正向移动,从而增大了产率,
为可逆反应,生成物中有水生成,步骤①中使用分水器不断分离除去水,可以使生成物的浓度减小,化学平衡向着正向移动,从而增大了产率,
故答案为:使平衡不断地向正向移动;
(4)加入碳酸钠的目的是除去苯甲酸乙酯中的苯甲酸,若加入的碳酸钠不足,则产品中存在苯甲酸,而苯甲酸在100℃会迅速升华,则蒸馏时会出现白烟现象,
故答案为:在苯甲酸乙酯中有未除净的苯甲酸,受热至100℃时升华;
(5)分液漏斗有旋塞,所以使用分液漏斗前必须检查是否漏水,
故答案为:检查是否漏水;
(6)根据反应 可知,理论上4.0g苯甲酸与足量乙醇反应生成苯甲酸乙酯的质量为:$\frac{4.0g}{122g/mol}$×150g/mol=4.92g,实际上获得苯甲酸乙酯的质量是:2.3mL×1.05g/mL=2.415g,
可知,理论上4.0g苯甲酸与足量乙醇反应生成苯甲酸乙酯的质量为:$\frac{4.0g}{122g/mol}$×150g/mol=4.92g,实际上获得苯甲酸乙酯的质量是:2.3mL×1.05g/mL=2.415g,
所以本实验的产率为:$\frac{2.415g}{4.92g}$×100%=49.1%,
故答案为:49.1%.
点评 本题考查了物质制备方案的设计,题目难度中等,明确制备原理为解答关键,试题涉及酯化反应原理、化学实验基本操作方法、产率的计算、化学平衡的影响因素等知识,注意掌握物质制备方案的设计及评价原则,试题充分考查了学生的分析能力及灵活应用基础知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 金属铯的熔点比金属钠高 | B. | CsOH比NaOH的碱性强 | ||
| C. | Cs与H2O能剧烈反应,但没有钠剧烈 | D. | 碳酸铯难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
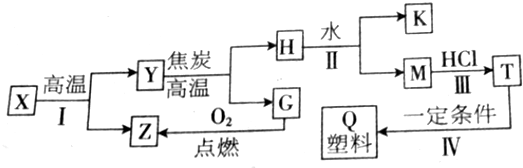

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
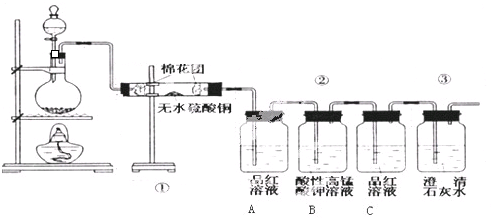
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
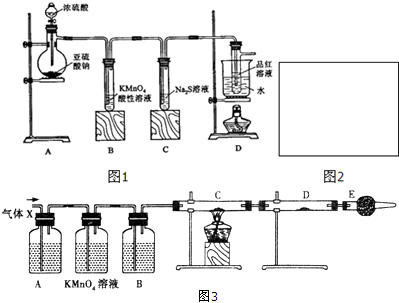
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mol甲醇参加反应,放出的热量为25kJ | |
| B. | 浓硫酸在反应中只作催化剂 | |
| C. | 2υ(CH3OH)=υ(CH3OCH3) | |
| D. | 升高温度或增大压强均可加快反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
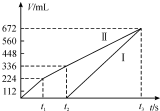 常温下用惰性电极电解200mLNaCl、CuSO4的混合溶液,所得气体的体积随时间变化如图所示,根据图中信息回答下列问题,(气体体积已换算成标准状况下的体积,且忽略气体在水中的溶解和溶液体积的变化)
常温下用惰性电极电解200mLNaCl、CuSO4的混合溶液,所得气体的体积随时间变化如图所示,根据图中信息回答下列问题,(气体体积已换算成标准状况下的体积,且忽略气体在水中的溶解和溶液体积的变化)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 或
或 .
. 、
、 、
、 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com