
| A. | 0.2 mol Al与足量NaOH溶液反应,生成的H2体积为6.72L | |
| B. | 常温下pH=1的盐酸溶液中的H+离子数目为0.1NA | |
| C. | 铅蓄电池中,当正极增加9.6g时,电路中通过的电子数目为0.3NA | |
| D. | 11P4+60CuSO4+96H2O═20Cu3P+24H3PO4+60H2SO4反应中,6 mol CuSO4能氧化白磷的分子数为1.1NA |
分析 A.Vm的数值不知,不能确定H2体积;
B.缺少溶液的体积V,不能计算溶质中H+离子数目;
C.正极由PbO2→PbSO4,每增重64g转移2mol电子;
D.Cu3P中Cu显+1价,60mol CuSO4参加反应得到60mol电子,P4被氧化到H3PO4,每有1molP4被氧化失去电子20mol,故6 mol CuSO4能氧化0.3 mol白磷.
解答 解:A.0.2 mol Al与足量NaOH溶液反应,生成0.3molH2,Vm的数值不知,不能确定H2体积,故A错误;
B.缺少溶液的体积V,不能计算溶质中H+离子数目,故B错误;
C.铅蓄电池中,正极:PbO2→PbSO4,每增重64g时转移2mol电子,所以正极增重9.6g转移电子数为0.3NA,故C正确;
D.Cu3P中Cu显+1价,所以60 mol CuSO4参加反应得到60 mol 电子,P4被氧化到H3PO4,每有1 mol P4被氧化失去电子20 mol,所以6 mol CuSO4能氧化0.3 mol 白磷,能氧化白磷的分子数为0.3NA,故D错误;
故选C.
点评 本题考查阿伏伽德罗常数的计算与判断,题目难度中等,涉及知识点较多、综合性较强,充分考查学生的分析、理解能力及灵活应用基础知识的能力,注意熟练掌握物质的量与阿伏伽德罗常数、摩尔质量等物理量之间的关系.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
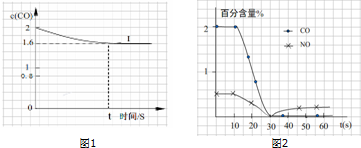
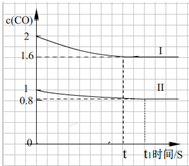 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
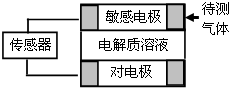 气体的自动化检测中常常应用原电池原理的传感器.如图为电池的工作示意图.气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号.下表列出了待测气体及敏感电极上部分反应产物.则下列说法中正确的是( )
气体的自动化检测中常常应用原电池原理的传感器.如图为电池的工作示意图.气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号.下表列出了待测气体及敏感电极上部分反应产物.则下列说法中正确的是( )| 待测气体 | 部分电极产物 |
| NO2 | NO |
| Cl2 | HCl |
| CO | CO2 |
| SO2 | H2SO4 |
| A. | 上述气体检测时,敏感电极均作电池负极 | |
| B. | 检测分别含SO2和CO体积分数相同的两份体积相同的空气样本时,传感器上产生的电流大小相同 | |
| C. | 检测CO时,敏感电极上的电极反应式为CO+2OH--2e-═CO2+H2O | |
| D. | 检测NO2时,电解质溶液可选NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 正极反应为Zn-2e-═Zn2+ | |
| B. | 电池总反应为Zn+Cu2+═Zn2++Cu | |
| C. | 取出盐桥,电流表指针仍然偏转 | |
| D. | 盐桥(填充KCl饱和溶液侵泡的琼脂)中的K+移向ZnSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH在5.6~7.0之间的降水通常称为酸雨 | |
| B. | 海水资源的利用包括水资源的利用和化学资源的利用,两者可以综合进行 | |
| C. | 工业上用电解饱和氯化钠溶液的方法制得金属钠 | |
| D. | 含磷合成洗涤剂易于被细菌分解,故不会导致水体污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
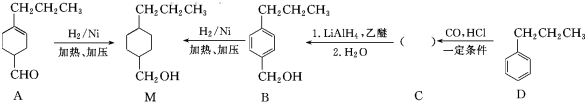
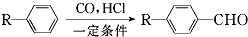
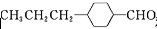 和
和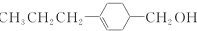 (写结构简式)生成.
(写结构简式)生成.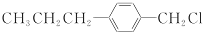 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
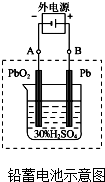 (1)铅蓄电池是典型的可充型电池,电池总反应式为:Pb+PbO2+4H++2SO42-$?_{充电}^{放电}$2PbSO4+2H2O
(1)铅蓄电池是典型的可充型电池,电池总反应式为:Pb+PbO2+4H++2SO42-$?_{充电}^{放电}$2PbSO4+2H2O查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com