

| 氢氧化物 | Al(OH)3 | Mg(OH)2 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 3.10 | 8.54 | 2.01 | 7.11 |
| 完全沉淀的pH | 4.77 | 11.04 | 3.68 | 9.61 |
| Ksp |
| c(OH-)3 |
| 2.0×10-33 |
| (1×10-9)3 |
| bg×98% |
| 160g/mol |
| b×98% |
| 80 |
| ||
| ag |
| b×98.0%×56 |
| 80a |
| b×98.0%×56 |
| 80a |


科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.分离KNO3和氯化钠,常用结晶与重结晶 |
| B.提纯含有碘的食盐,常用升华法 |
| C.去除乙醇中的水分常用蒸馏法 |
| D.分离苯和酸性高锰酸钾溶液可用分液法 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

| 物质 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 293K溶解度(g) | 111 | 33.7 | 11.1 | 217 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
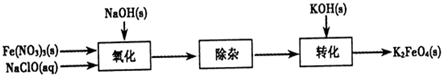
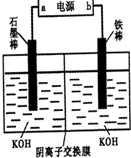
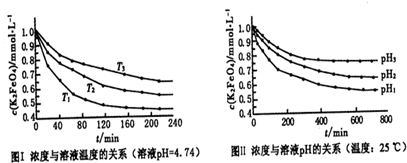
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
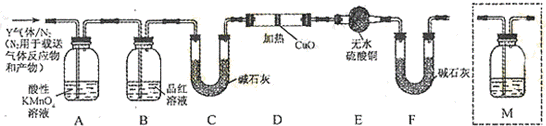
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
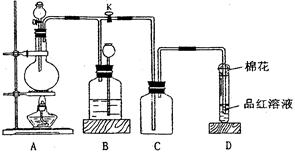
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com