
| A、在水溶液中:H+、I-、NO3-、SiO32- |
| B、饱和氯水中:Cl-、NO3-、Na+、SO32- |
| C、将足量CO2通入时:H+、NH4+、Al3+、SO42- |
| D、碱性溶液中:NO3-、I-、Na+、Al3+ |


科目:高中化学 来源: 题型:
 我国工业上主要采用以下四种方法降低尾气中的含硫量:
我国工业上主要采用以下四种方法降低尾气中的含硫量:| 方法1 | 燃煤中加入石灰石,将SO2转化为CaSO3,再氧化为CaSO4 |
| 方法2 | 用氨水将SO2转化为NH4HSO3,再氧化为(NH4)2SO4 |
| 方法3 | 高温下用水煤气将SO2还原为S |
| 方法4 | 用Na2SO3溶液吸收SO2,再电解转化为H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化亚铁加入稀硝酸:FeO+2H+=Fe2++H2O |
| B、铝片加入烧碱溶液:2Al+2OH-+2H2O=2AlO2-+3H2↑ |
| C、碳酸氢铵溶液和足量氢氧化钠溶液混合:HCO3-+OH-=CO32-+H2O |
| D、硅酸钠溶液和稀硫酸混合:Na2SiO3+2H+=H2SiO3↓+2Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NA个N2与0.5NA个H2物质的量之比为2:1 |
| B、标准状况下,11.2LBr2含有的原子数为NA |
| C、5.6L氯气和16.8L氧气的混合气体中所含的分子数一定为NA |
| D、1mol/LNaCl溶液中含有NA个氯离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、②④ |
| C、①④ | D、②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 将洁净的三种金属片X、Y和Z分别放置在浸有食盐溶液的滤纸上并压紧(如图).每次实验时,电压表指针的偏移方向和读数如下表.已知构成两电极的金属,活泼性相差越大,则电压越大.对X、Y、Z和铜四种金属的下列说法,不正确的是( )
将洁净的三种金属片X、Y和Z分别放置在浸有食盐溶液的滤纸上并压紧(如图).每次实验时,电压表指针的偏移方向和读数如下表.已知构成两电极的金属,活泼性相差越大,则电压越大.对X、Y、Z和铜四种金属的下列说法,不正确的是( )| 金属片 | 电子流向 | 电压(V) |
| X | X→Cu | +0.78 |
| Y | Cu→Y | -0.15 |
| Z | Z→Cu | +1.35 |
| A、Z金属可作为牺牲阳极保护法的阳极,保护Y金属 |
| B、Y金属不能从硫酸溶液中置换出氢气 |
| C、三种金属的活泼性顺序为:Z>X>Y |
| D、X和Y能构成电压最大的原电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| H2CO3 | Ka1=4.3×10-7 | H2C2O4 | Ka1=5.6×10-2 |
| Ka2=5.6×10-11 | Ka2=5.42×10-5 |
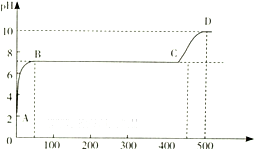
查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定序号 | 待测液体积∕mL | 消耗KMn04溶液体积∕mL |
| 1 | 25.00 | 19.98 |
| 2 | 25.00 | 19.12 |
| 3 | 25.00 | 20.02 |
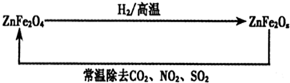
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将氯化铁溶液与碳酸氢钠溶液混合:2Fe3++3HCO3?+3H2O=2Fe(OH)3↓+3CO32? |
| B、向NaAlO2溶液中通入过量CO2气体:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- |
| C、向AgBr悬浊液中滴加NaI溶液并充分振荡:Ag++I-=AgI↓ |
| D、向NH4HCO3溶液中加入过量烧碱溶液并微热:NH4++OH-=NH3↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com