

| A、阳极上的电极反应均为2Cu-2e-+2OH-═Cu2O+H2O |
| B、工作过程中两个装置内溶液的pH均减小 |
| C、两个装置内阴离子均移向铜电极 |
| D、阴极上开始时均有氢气生成 |
| ||
| ||


科目:高中化学 来源: 题型:
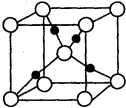 已知A、B、C、D均为前四周期元素且原子序数依次增大,元素A的基态原子2p轨道有3个未成对电子,元素B的原子最外层电子数是其内层电子数的3倍,元素C的一种常见单质为淡黄色粉末,D的内层轨道全部排满电子,且最外层电子数为l.
已知A、B、C、D均为前四周期元素且原子序数依次增大,元素A的基态原子2p轨道有3个未成对电子,元素B的原子最外层电子数是其内层电子数的3倍,元素C的一种常见单质为淡黄色粉末,D的内层轨道全部排满电子,且最外层电子数为l.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、H+、I-、ClO- |
| B、Na+、Fe3+、SO42-、OH- |
| C、Al3+、NH4+、AlO2-、NO3- |
| D、Mg2+、Ca2+、HCO3-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:
226 88 |
| A、Ra元素位于元素周期表中第六周期ⅡA |
| B、RaSO4难溶于水和强酸 |
| C、RaCO3不能与盐酸反应 |
| D、Ra(OH)2是一种两性氢氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所有的复分解反应都是非氧化还原反应 |
| B、能与酸反应的氧化物,一定是碱性氧化物 |
| C、同一元素不可能既表现金属性,又表现非金属性 |
| D、以共价键形成的单质中只存在非极性键,以共价键形成的化合物中只存在极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,CH3COONa和CH3COOH混合溶液pH=7,且c(Na+)=0.1mol?L-1:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) |
| B、在0.1mol?L-1 Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) |
| C、向0.2mol?L-1 NaHCO3溶液中加入等体积0.1mol?L-1 NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| D、在0.1mol?L-1 NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2与H2O反应:Cl2+H2O═2H++Cl-+ClO- |
| B、向氯化铁溶液中加氢碘酸能使溶液变为无色 |
| C、向NaClO溶液中通入少量的CO2:2ClO-+CO2+H2O═2HClO+CO32- |
| D、200mL 2mol/L的FeBr2溶液中通入11.2L标准状况下的Cl2:4Fe2++2Br-+5Cl2═4Fe3++3Br2+10Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |

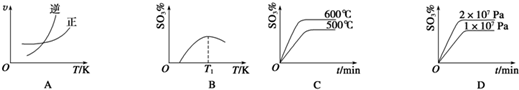
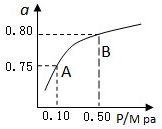
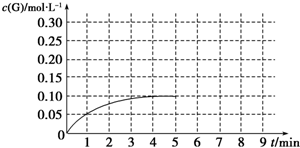
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com