
����Ŀ��������Ӧ��ͼ��(ͼ�������һһ��Ӧ)���ж��������˵����ȷ����( )
ѡ�� | A | B | C | D |
ͼ�� |
|
|
|
|
��Ӧ | aX(g)+bY(g)cZ(g) | L(s)+aG(g)bR(g) | aA+bBcC | A+2B2C+3D |
���������� | �ܱ������з�Ӧ�ﵽƽ�⣬T0ʱ�ı�ijһ��������ͼ�仯��ʾ����ı������һ���Ǽ������ | ��Ӧ�ﵽƽ��ʱ�����������ƽ��Ӱ���ϵ��ͼ��ʾ��������ӦΪ���ȷ�Ӧ����a>b | ���ʵİٷֺ������¶ȹ�ϵ��ͼ��ʾ����÷�Ӧ������ӦΪ���ȷ�Ӧ | ��Ӧ���ʺͷ�Ӧ�����仯��ϵ��ͼ��ʾ����÷�Ӧ������ӦΪ���ȷ�Ӧ��A��B��C�����壬DΪ�����Һ�� |
A.AB.BC.CD.D
���𰸡�D
��������
A.��ͼ�������֪�������ı䣬��ѧ��Ӧ��������ѧƽ�ⲻ������ı���������Ϊ���������Ӧǰ�������������ʱ����ѹǿ����A����
B.��ͼ���֪�������¶ȣ�G�����������С��˵��ƽ��������Ӧ�����ƶ����÷�Ӧ�����ȷ�Ӧ�����Ƿ��ȷ�Ӧ����B����
C.��ͼ���֪��T2�ﵽƽ�⣬ƽ��������¶ȣ�C�����ʵ�����С��˵��ƽ�����淴Ӧ�����ƶ����÷�ӦΪ���ȷ�Ӧ����C����
D.��ͼ���֪�������¶ȣ���ѧ��Ӧ���ʼ�С��ƽ��������Ӧ�����ƶ����÷�ӦΪ���ȷ�Ӧ������ѹǿ����ѧ��Ӧ��������ƽ��������Ӧ�����ƶ�������Ӧ���ʴ����淴Ӧ���ʣ�˵����Ӧǰ�����������С����A. B.C�����壬Dһ��Ϊ�����Һ�壬��D��ȷ��
��ѡD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�ᾧˮ���ﺬ��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() �е��������ӣ�ʵ��С��Ϊȷ���仯ѧʽ��������ʵ�飺
�е��������ӣ�ʵ��С��Ϊȷ���仯ѧʽ��������ʵ�飺
![]() ȷ��ȡ
ȷ��ȡ![]() ��Ʒ�����Ƴ�
��Ʒ�����Ƴ�![]() ��ҺX��
��ҺX��
![]() ȡ
ȡ![]() ��ҺX�������������ᣬ�����������ټ�����
��ҺX�������������ᣬ�����������ټ�����![]() ��Һ��������ɫ���������������ˡ�ϴ�ӡ����������أ��ð�ɫ����
��Һ��������ɫ���������������ˡ�ϴ�ӡ����������أ��ð�ɫ����![]() ��
��
![]() ȡ
ȡ![]() ��ҺX����������ϡ�����ữ����
��ҺX����������ϡ�����ữ����![]() ��Һ�ζ����յ㣬�ظ��ζ����Σ��������
��Һ�ζ����յ㣬�ظ��ζ����Σ��������![]() ��Һ�����ƽ��ֵΪ
��Һ�����ƽ��ֵΪ![]() ��
��
![]() �����ͼ��ʾ��װ�ã�ȡ
�����ͼ��ʾ��װ�ã�ȡ![]() ��Һ������ʵ�飬ʵ��ǰ��Bװ������
��Һ������ʵ�飬ʵ��ǰ��Bװ������![]() ��
��
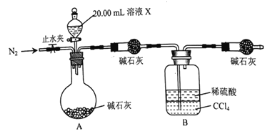
![]() ȡ������ҺX���μ�
ȡ������ҺX���μ�![]() ��Һ�����������������еμ�
��Һ�����������������еμ�![]() ��Һ���а�ɫ�������ɡ�
��Һ���а�ɫ�������ɡ�
�ش��������⣻
![]() ���ʵ��
���ʵ��![]() ����Ҫ�IJ��������У��ձ�������������Ͳ��____________��
����Ҫ�IJ��������У��ձ�������������Ͳ��____________��
![]() ʵ��
ʵ��![]() �ﵽ�ζ��յ��������_____________________��
�ﵽ�ζ��յ��������_____________________��
![]() ʵ��
ʵ��![]() �ķ�Ӧ������ֹˮ��ͨ��
�ķ�Ӧ������ֹˮ��ͨ��![]() ��������________________��
��������________________��
![]() ��������ʵ�����ݼ���ýᾧˮ����Ļ�ѧʽΪ______________��
��������ʵ�����ݼ���ýᾧˮ����Ļ�ѧʽΪ______________��
![]() ijͬѧ�������Ϸ��� AgSCNΪ��ɫ�����
ijͬѧ�������Ϸ��� AgSCNΪ��ɫ�����![]() ��������
��������![]() ��
��![]() ��Ϊ̽��
��Ϊ̽��![]() ��
��![]() �Ļ�ԭ��ǿ������ͬѧ�������ͼʵ��װ�ò���������ʵ�顣
�Ļ�ԭ��ǿ������ͬѧ�������ͼʵ��װ�ò���������ʵ�顣
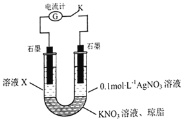
�ȶϿ����K������ҺX�еμ�![]() ��Һ������������˵��_____________���պϵ��K�����۲쵽��ʵ����������ҺX��졢�ұ�ʯī�缫���й���������������ָ��ƫת���ݴ˵ó��Ľ�����_____________����Һ����ԭ����___________
��Һ������������˵��_____________���պϵ��K�����۲쵽��ʵ����������ҺX��졢�ұ�ʯī�缫���й���������������ָ��ƫת���ݴ˵ó��Ľ�����_____________����Һ����ԭ����___________![]() �����ӷ���ʽ��ʾ
�����ӷ���ʽ��ʾ![]() ����ʵ����Ƶ��ŵ���_______________��
����ʵ����Ƶ��ŵ���_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о���������ķ�Ӧ����������������Ի�������Ⱦ����Ҫ���塣��ش������뵪Ԫ���йص�����:
(1)��������(�ṹʽΪCl-N=O)���л��ϳ��е���Ҫ�Լ���������Cl2��NO��ͨ�������·�Ӧ�Ƶã���Ӧ����ʽΪ2NO(g)+Cl2(g) ![]() 2ClNO(g)����֪���ֻ�ѧ�ļ����������±���ʾ:
2ClNO(g)����֪���ֻ�ѧ�ļ����������±���ʾ:

��Cl2��NO��Ӧ����ClNO�Ĺ�����ת����4mol���ӣ������Ϸų�������Ϊ____kJ.
(2)��һ�������ܱ������г���2molNO(g)��1 mol Cl2(g)����(1)�з�Ӧ�����¶ȷֱ�ΪT1��T2ʱ���NO�����ʵ���(��λ:mol)��ʱ��Ĺ�ϵ���±���ʾ
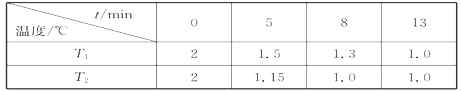
��T1________T2(�>������������)��
���¶�ΪT2��ʱ������ͬ�����У�����4molNO(g)��2mo1Cl2(g)����NO��ƽ��ת����___________50%(����ڡ��������ڡ���С�ڡ�)
���¶�ΪT2��ʱ����ʼʱ�����ڵ�ǿΪp0����÷�Ӧ��ƽ�ⳣ��Kp=______(��ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ����ѹ�����ʵ�������)��
(3)������������ˮ�еĵ���Ⱦ�ѳ�Ϊһ�������ԵĻ������⡣�ڽ���Pt��Cu��ҿ(Ir)�Ĵ������£��ܱ������е�H2�ɸ�Чת��������Һ�е���̬��(NO3-)���乤��ԭ����ͼ��ʾ
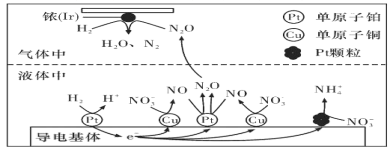
��Ir���淢����Ӧ�ķ���ʽΪ_________________________________________________��
������������ϵ�Pt�������࣬��ɵĺ����___________________________________��
II:���õ绯ѧԭ������NO2��O2������KNO3�Ƴ�ȼ�ϵ�أ�ģ�ҵ��ⷨ����������װ����ͼ��ʾ
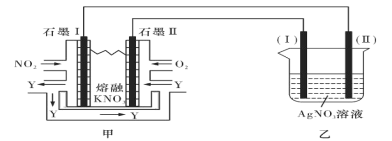
��ش���������:
(4)�ټ׳ع���ʱ��NO2ת�����ɫ������Y��Y��N2O5����ѭ��ʹ�ã���ʯīII���������ĵ缫��ӦʽΪ____________________________________________��
������10A�ĵ������60min����֪�õ��صĵ��Ч��Ϊ80.4���������������õ�____g������Ag��(����С�����һλ��ͨ��һ������ʱ������ʵ�ʳ����Ľ���������ͨ����ͬ����ʱ������Ӧ�����Ľ�������֮�Ƚе��Ч�ʡ������ڳ���Ϊ96500C/mol)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����2H2O(g)===2H2(g)��O2(g)����H����483.6 kJ��mol��1 ��H2S(g)===H2(g)��S(g)����H����20.1 kJ��mol��1�����ж���ȷ����(����)
A. ������ȼ���ȣ���H����241.8 kJ��mol��1
B. ��ͬ�����£����ȼ��1 mol H2(g)��1 mol S(g)�Ļ����ȳ��ȼ��1 mol H2S(g)���ȶ�20.1 kJ
C. �ɢ٢�֪��ˮ�����ȶ���С������
D. ���������ɹ�̬����H������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)�������ʣ�����������ͭƬ����̼��ơ������ǡ���HCl���塢��SO2���塢�߰�ˮ���ܵ������________________�����ڵ���ʵ���_________________��(����)
(2)����������õ���____��Ӧ�����������ҹ���γ�������ɫ�Ĺ���������___ЧӦ��
(3)�ٳ�ȥ�����л������ۣ�ѡ�õ��Լ�Ϊ��___________��
��NaHCO3��Һ�л���Na2CO3ѡ�õ��Լ�Ϊ_____________��
�۳�ȥNa2CO3��ĩ�е�NaHCO3�����õķ���__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ɱ��400 ���ܱ������У�һ������SO2��O2�ڴ��������·�����Ӧ��2SO2(g)+O2(g) 2SO3(g)+QkJ����������������ǣ� ��
2SO3(g)+QkJ����������������ǣ� ��
A.����ѹǿ������Ӧ����һֱ���������䣬ƽ������
B.�����¶ȣ�����Ӧ���ʱ��淴Ӧ���ʼ�С�ij̶�С
C.��������������������ƽ�������ƶ���ƽ�ⳣ��Kֵ����
D.����������ʵ�������0.5molʱ�ﵽƽ�⣬��������·�Ӧ�ų�0.5QkJ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ԭ�������ĵ��������ֶ�����Ԫ�أ�����ĸx��y��z������ʾ����ԭ�Ӱ뾶��Դ�С��������ۻ�����۵ı仯����ͼ��ʾ��
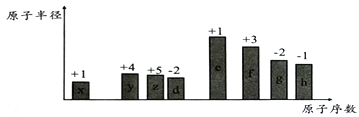
��ش��������⣺
��1��f�����ڱ��е�λ��Ϊ______________��x�γɵ������ӵĽṹʾ��ͼΪ_____________________��
��2���Ƚ�d��e�������ӵİ뾶��С��__________________���ѧʽ����ͬ�����Ƚ�g��h������������Ӧˮ���������ǿ����_______________________��
��3��x��y��z��d����Ԫ�����γɶ��ֻ����
�����γ����ӻ��������һ��x��y��z��d����ԭ�ӵĸ�����Ϊ5��2��1 ��4���仯ѧʽΪ__________________________��
�����γɹ��ۻ����д������һ�ֵĽṹ��ʽ____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��B��C��D����Ԫ�ص�ԭ������֮�͵���36.A�ĵ�������������壻B�Ļ�̬ԭ����3����ͬ���ܼ������ܼ��е�������ȣ�D�С����������֮�ƣ��䵥�ʺͻ������й㷺����;��D4+���Ӻ��ԭ�ӵĺ�������Ų���ͬ.��ҵ������DO2��̼�ᱵ������״̬����ȡ�������(�ɿ���һ�ֺ�������).��������������ġ�ѹ�����ܡ���Ӧ���ڳ������ķ���װ��.��X���߷��������������ľ����ṹΪ������(����ͼ��ʾ)������Ba2+ռ������λ�ã�O2-ռ������λ�ã�D4+ռ�ݶ���λ��.
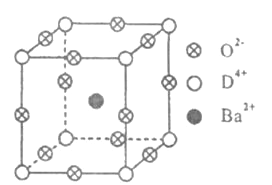
��ش��������⣺
��1��A��B��C����Ԫ�صĵ縺���ɴ�С��˳����__________________(��Ԫ�ط���).
��2��BA4���ӵĿռ乹����______________��Bԭ�ӹ�����ӻ�����Ϊ_____.
��3��C����̬�⻯��ĵ���ʽΪ____����е����ͬ��������Ԫ���⻯��ķе㣬��Ҫԭ����____________________.
��4��D�Ļ�̬ԭ�Ӻ�������Ų�ʽΪ____________________.
��5�����Ʊ�������Ļ�ѧ����ʽΪ____________________.
���ڼ����У�����D4+��������������ģ�Ba2+����������Ķ��㣬��O2-�����������__________.
���ڼ����У�D4+������λ��Ϊ__________.
����֪�����Ħ������ΪM g/mol���侧���߳�Ϊ4.03��10-10m���������ܶ�Ϊ__________________g/cm3(Ҫ���г���ʽ�������ӵ�������NA��ʾ).
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݱ�Ţ١��������Ԫ�������ڱ��е�λ�ã��ش��������⣺
�� ���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
1 | �� | �� | ||||||
2 | �� | �� | �� | �� | ||||
3 | �� | �� | �� | �� |
��1���������Ϊ+1�ۣ������ԩ�1�۵�Ԫ����____����Ԫ�ط��ţ����ߡ��ࡢ������Ԫ������������Ӧ��ˮ���������ǿ������˳������Ϊ________���ѧʽ����
��2���۵ĵ����ڿ����г��ȼ�յĻ�ѧ����ʽ��________________________________��������γɵ��ȶ�������ĵ���ʽΪ______________��
��3���١��ݡ�������Ԫ���γɵ�һ�ֳ����εĻ�ѧʽΪ________________�����к��еĻ�ѧ������Ϊ_________________��
��4�����������ɢ�����γɵĻ�����ʱ�������___ɫ���ݵ����������ˮ�����ϡ��Һ�����ͭ��Ӧ�����ӷ���ʽΪ______________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com