

| ||
| △ |
| ||
| △ |


 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:
| A、对废旧电池进行回收处理 |
| B、使用沼气、太阳能、风能等能源替代传统的煤炭 |
| C、对聚乙烯等塑料进行深埋或倾倒入大海 |
| D、出台法规保护生物物种多样性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使用催化剂可以加快反应速率 |
| B、升高温度可以加快反应速率 |
| C、使用过量乙醇能使乙酸完全转化为乙酸乙酯 |
| D、该反应属于取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
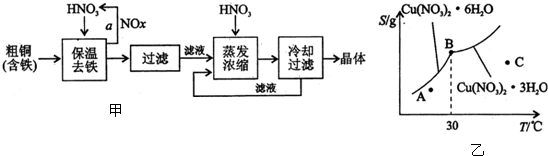
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
| ||
| 一定条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E为中学化学常见物质,其中A、C为金属单质,E为非金属单质,如图是它们之间的相互转化关系.请回答:
A、B、C、D、E为中学化学常见物质,其中A、C为金属单质,E为非金属单质,如图是它们之间的相互转化关系.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 右图是A-E五种含氮物质相互转化的关系图,其中A、B、C、D常温下都是气体,B为红棕色.
右图是A-E五种含氮物质相互转化的关系图,其中A、B、C、D常温下都是气体,B为红棕色.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com