
【题目】几种物质间的相互转化关系如图所示

请回答
(1)A转化为B及气体的反应中应加入的试剂是(填化学式) 。
(2)写出B的化学式: ,F的化学式: 。
(3)写出G转化为H的化学方程式: 。
(4)写出检验D溶液中金属阳离子的方法: (用离子方程式表示);向D溶液中加入A,发生反应的离子方程式是 。
【答案】(1)HCl
(2)FeCl2;KCl
(3)4Fe(OH)2+ O2+2H2O=4Fe(OH)3
(4)Fe3+ +3SCN-=Fe(SCN)3;2Fe3++Fe=3Fe2+
【解析】
试题分析:F与硝酸酸化的硝酸银溶液产生白色沉淀J,则F中含有氯离子,J是AgCl,所得溶液焰色反应呈紫色,则溶液中含有钾离子,根据元素守恒知,F为KCl,白色沉淀G在空气中转化为红褐色沉淀H,则G是Fe(OH)2,H是Fe(OH)3,氢氧化铁和盐酸反应生成氯化铁和水,则D是FeCl3;B和E发生复分解反应生成KCl和Fe(OH)2,且氯化铁和A反应生成B,则B为FeCl2,A是Fe,E为KOH,由A与试剂反应生成B与气体,则试剂为盐酸、气体为氢气,B与足量的气体C反应生成D,则C为氯气,
(1)通过以上分析知,A转化为B及气体这步反应中应加入的试剂是盐酸。
(2)由上述分析可知,B的化学式为FeCl2,F的化学式KCl。
(3)Fe(OH)2被氧气氧化生成氢氧化铁,反应方程式为4Fe(OH)2+ O2+2H2O=4Fe(OH)3。
(4)DD是FeCl3,铁离子和硫氰化钾溶液反应生成血红色溶液,所以铁离子可以用硫氰化钾溶液检验,反应离子方程式为:Fe3++3SCN-=Fe(SCN)3;氯化铁和铁反应生成氯化亚铁,反应离子反应方程式为2Fe3++Fe=3Fe2+。


科目:高中化学 来源: 题型:
【题目】化学与生活息息相关。下列叙述正确的是( )
A.鲜榨橙汁遇到碘水会变蓝 B.馒头越嚼越甜
C.油脂经水解可变成葡萄糖 D.土豆中的淀粉经水解可变成酒(乙醇)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下存在反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),ΔH<0。现有三个相同的2L恒
CO2(g)+H2(g),ΔH<0。现有三个相同的2L恒
容绝热(与外界没有热量交换) 密闭容器I、II、III,在I中充入1 mol CO和1 mol H2O,在II中充入1 mol CO2和1 mol H2,在III中充入2 mol CO 和2 mol H2O,700℃条件下开始反应。达到平衡时,下列说法正确的是( )
A. 容器I、II中正反应速率相同
B. 容器I中CO 的物质的量比容器II中的多
C. 容器I、III中反应的平衡常数相同
D. 容器I中CO 的转化率与容器II中CO2的转化率之和等于1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与日常生活密切相关,下列说法错误的是( )
A. 氢氧化铝可作抗酸药 B. “84”消毒液的有效成分是NaClO
C. 浓硫酸可刻蚀石英制艺术品 D. 酱油中添加的补铁剂中含有维生素C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO是现代化工生产的基础原料,下列有关问题都和CO的使用有关。
(1) 工业上可利用CO生产乙醇:
2CO(g)+4H2(g)![]() CH3CH2OH(g)+H2O(g) ΔH1
CH3CH2OH(g)+H2O(g) ΔH1
又已知:H2O(l)=== H2O(g) ΔH2
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3
工业上也可利用CO2(g)与H2(g)为原料合成乙醇:
2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(l) ΔH
CH3CH2OH(g)+3H2O(l) ΔH
则:ΔH与ΔH1、ΔH2、ΔH3之间的关系是:ΔH=___________________。
(2)一定条件下,H2、CO在体积固定的密闭容器中发生如下反应:
4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g),下列选项能判断该反应达到平衡状态的依据的有___ 。
CH3OCH3(g)+H2O(g),下列选项能判断该反应达到平衡状态的依据的有___ 。
A.2v(H2)= v(CO)
B.CO的消耗速率等于CH3OCH3的生成速率
C.容器内的压强保持不变
D.混合气体的密度保持不变
E.混合气体的平均相对分子质量不随时间而变化
(3)工业可采用CO与H2反应合成再生能源甲醇,反应如下:
CO(g)+ 2H2(g)![]() CH3OH(g)在一容积可变的密闭容器中充有10molCO和20molH2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(p)的关系如(图1)所示。
CH3OH(g)在一容积可变的密闭容器中充有10molCO和20molH2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(p)的关系如(图1)所示。

①合成甲醇的反应为 (填“放热”或“吸热”)反应。
②A、B、C三点的平衡常数KA、KB、KC的大小关系为 。
③若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为_________L。
④(图2)中虚线为该反应在使用催化剂条件下关于起始氢气与CO投料比和CO平衡转化率的关系图. 当其条件完全相同时,用实线画出不使用催化剂情况下CO平衡转化率的示意图.
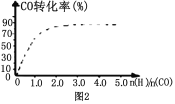
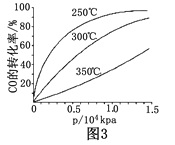
⑤CO的平衡转化率(α)与温度(T)、压强(p)的关系如(图3)所示,实际生产时条件控制在250 ℃、 1.3×104 kPa左右,选择此压强的理由是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当航天飞机返回地球进入大气层时,由于空气的剧烈磨擦,航天飞机尖端的温度可达1000℃以上.为了防止极高的温度将其烧毁,科学家给航天飞机相应部位设计安装了可靠的保护层.制作保护层的材料可能为( )
A.合成塑料
B.合成纤维
C.镁铝合金
D.新型陶瓷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮及其化合物在工农业生产生活中有着重要作用,请回答下列问题:
(1)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2
若2 molCH4还原NO2至N2,整个过程中放出的热量为1734 kJ,则△H2=_________;
(2)据报道,科学家在一定条件下利用Fe2O3与甲烷反应可制取“纳米级”的金属铁,其反应如下:Fe2O3(s)+3CH4(g)===2Fe(s)+3CO(g)+6H2(g) △H>0
① 若反应在5 L的密闭容器中进行,1 min后达到平衡,测得Fe2O3在反应中质量减少3.2g。则该段时间内CO的平均反应速率为__________mol/(L·s)
② 若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是__________(选填序号)
A.CH4的转化率等于CO的产率
B.混合气体的平均相对分子质量不变
c.v(CO)与v(H2)的比值不变
D.固体的总质量不变
③该反应达到平衡时某物理量随温度变化如图所示,当温度由T1升高到T2时,平衡常数KA________KB(填“>”、“<”或“=”),纵坐标表示的物理量可能是__________(填字母)。
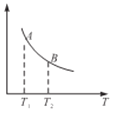
A.H2的逆反应速率
B.CH4的的体枳分数
C.混合气体的平均相对分子质量
D.CO的体积分数
(3)而一些科学家采用高质子导电性的SCY陶瓷(能传递H+)实现氨的电化学合成,从而大大提高了氮气和氢气的转化率。电化学合成氨过程的总反应式为N2+3H2![]() 2NH3,该过程中还原反应的方程式为________________。
2NH3,该过程中还原反应的方程式为________________。
(4)若往20 mL0.01mol/L的弱酸HNO2溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如下图所示,下列有关说法正确的是_____________(填标号)
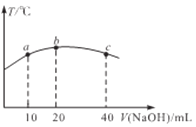
①该烧碱溶液的浓度为0.02mol/L
②该烧碱溶液的浓度为0.01mol/L
③HNO2的电离平衡常数:b点>a点
④从b点到c点,混合溶液中一直存在:c(Na+)> c(NO2-) >c(OH-)> c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3﹣═3Fe3++NO↑+3H2O
B.向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2﹣+CO2+2H2O═Al(OH)3↓+HCO3-
C.用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl﹣![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO﹣+2Fe(OH)3═2FeO42﹣+3Cl﹣+H2O+4H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com