
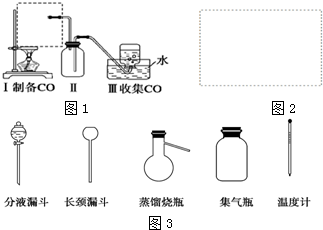
分析 该反应的制取原理为“固体与液体加热制取气体”,且需控制反应的温度,故发生装置应选用 ,CO不溶于水,可用排水法收集,为防倒吸,在发生装置与收集装置间加一个安全瓶,据此进行解答.
,CO不溶于水,可用排水法收集,为防倒吸,在发生装置与收集装置间加一个安全瓶,据此进行解答.
解答 解:①该反应的制取原理为 液+液$\stackrel{△}{→}$↑,故应选用分液漏斗和蒸馏烧瓶作为气体发生装置,温度计的水银球在液体中,测量反应液的温度,据此画出装置图为: ,
,
故答案为: ;
;
②生成的气体中含有CO、HCOOH和H2O,HCOOH易溶于水,会发生倒吸现象,需在收集前加一个安全瓶,故装置Ⅱ的作用是防止水槽中的水因倒吸流入蒸馏烧瓶中,
故答案为:防止水槽中的水因倒吸流入蒸馏烧瓶中.
点评 本题考查了化学实验装置的综合应用,题目难度中等,明确实验目的及发生反应的原理为解答关键,只有掌握化学实验装置的特点及综合应用方法,试题培养了学生的化学实验能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | 0 | |||||||
| 1 | ① | II A | III A | IV A | V A | VI A | VIIA | ||
| 2 | ② | ③ | Ne | ||||||
| 3 | ④ | ⑤ | Al | S | ⑥ | ||||
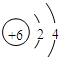 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知Al2H6燃烧热极高,是一种很好的生氢剂,它跟水反应生成H2,球棍模型如图(白球为Al,黑球为H).下列推测肯定不正确的是( )
已知Al2H6燃烧热极高,是一种很好的生氢剂,它跟水反应生成H2,球棍模型如图(白球为Al,黑球为H).下列推测肯定不正确的是( )| A. | 该物质与水反应,属于氧化还原反应 | |
| B. | Al2H6在空气中完全燃烧,产物为氧化铝和水 | |
| C. | Al2H6分子中 氢为+1价,铝为-3价 | |
| D. | 氢铝化合物可能成为未来的储氢材料和火箭燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化→加成→水解 | B. | 消去→加成→水解 | C. | 水解→消去→加成 | D. | 取代→水解→还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)═CH3OH (g)△H<0.按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是( )
用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)═CH3OH (g)△H<0.按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是( )| A. | 平均摩尔质量:a>c b<d | |
| B. | 正反应速率:a>c b>d | |
| C. | 平衡常数:a>b b=d | |
| D. | 平衡时a点一定满足CO与H2的物质的量之比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将AlCl3溶液和Al2(SO4)3溶液分别加热、蒸干、灼烧后所得固体成分相同 | |
| B. | 配制FeSO4溶液时,将FeSO4固体溶于稀盐酸中,然后稀释至所需浓度 | |
| C. | 用加热的方法可以除去KNO3溶液中混有的Fe3+ | |
| D. | 相同物质的量浓度的碳酸钠溶液和碳酸氢钠溶液后者pH大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水 易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com