
| A. | 由反应①知H2O2的氧化性比Fe3+强,由反应②知H2O2的还原性比Fe2+强 | |
| B. | 在反应①、②中H2O2均作氧化剂被还原 | |
| C. | 在H2O2分解过程中,Fe2+和Fe3+的总量保持不变 | |
| D. | H2O2生产过程要严格避免混入Fe2+ |
分析 A.反应2Fe2++H2O2+2H+═2Fe3++2H2O中,Fe2+被H2O2氧化生成Fe3+,故H2O2的氧化性比Fe3+强;反应2Fe3++H2O2═2Fe2++O2↑+2H+中,Fe3+被H2O2还原生成Fe2+,故H2O2的还原性比Fe2+强;
B、在反应①2Fe2++H2O2+2H+═2Fe3++2H2O中H2O2作氧化剂,而②反应2Fe3++H2O2═2Fe2++O2↑+2H+中H2O2均作还原剂被氧化;
C.总反应为2H2O2═2H2O+O2↑,Fe2+为H2O2分解的催化剂,Fe2+和Fe3+的总量保持不变;
D.因为Fe3+可导致H2O2分解.
解答 解:A.反应2Fe2++H2O2+2H+═2Fe3++2H2O中,Fe2+被H2O2氧化生成Fe3+,故H2O2的氧化性比Fe3+强;反应2Fe3++H2O2═2Fe2++O2↑+2H+中,Fe3+被H2O2还原生成Fe2+,故H2O2的还原性比Fe2+强,故A正确;
B、在反应①2Fe2++H2O2+2H+═2Fe3++2H2O中H2O2作氧化剂被还原,而②反应2Fe3++H2O2═2Fe2++O2↑+2H+中H2O2均作还原剂被氧化,故B错误;
C.总反应为2H2O2═2H2O+O2↑,Fe2+为H2O2分解的催化剂,Fe2+和Fe3+的总量保持不变,故C正确;
D.因为Fe2+可被氧化生成Fe3+,Fe3+导致H2O2分解,所以H2O2生产过程要避免混入Fe2+,故D正确.
故选:B.
点评 本题考查氧化还原反应,明确反应中氧化性的比较规律及两个化学反应的关系及催化剂在反应在的作用即可解答,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 26:9 | B. | 39:9 | C. | 40:9 | D. | 53:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤ | B. | ③④⑤ | C. | ②④⑤ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
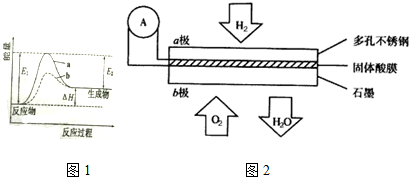
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
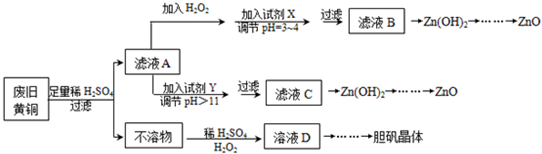
| Fe3+ | Fe2+ | Zn2+ | |
| 开始沉淀的pH | 1.1 | 5.8 | |
| 沉淀完全的pH | 3.0 | 8.8 | 8.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
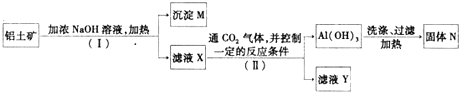
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
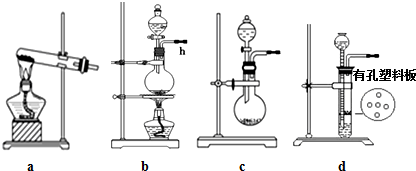
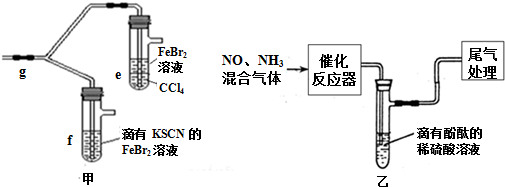
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+ | B. | OH- | C. | S2- | D. | Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com