
| A. | Fe溶于稀盐酸:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 用小苏打治疗胃酸过多:CO32-+2H+═CO2↑+H2O | |
| C. | 用FeCl3溶液腐蚀印刷电路板上铜箔:Fe3++Cu═Fe2++Cu2+ | |
| D. | 铝与浓氢氧化钠溶液反应:2Al+2OH-+2H2O═2AlO2-+3H2↑ |
分析 A.铁与稀盐酸反应生成亚铁离子;
B.小苏打为碳酸氢钠,碳酸氢根离子不能拆开;
C.离子方程式两边正电荷不相等,违反了电荷守恒;
D.铝与氢氧化钠溶液反应生成偏铝酸钠和氢气.
解答 解:A.Fe溶于稀盐酸生成氯化亚铁和氢气,正确的离子方程式为:Fe+2H+═Fe2++H2↑,故A错误;
B.用小苏打治疗胃酸过多,碳酸氢根离子不能拆开,正确的离子方程式为:HCO3-+H+═CO2↑+H2O,故B错误;
C.用FeCl3溶液腐蚀印刷电路板上铜箔,该反应不满足电荷守恒,正确的离子方程式为:2Fe3++Cu═2Fe2++Cu2+,故C错误;
D.Al与浓氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑,故D正确;
故选D.
点评 本题考查了离子方程式书写,题目难度中等,明确发生反应的实质为解答关键,注意掌握离子方程式的书写原则,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | C2H4(g)+3O2(g)═2CO2(g)+2H2O(l)△H=-2b kJ•mol-1 | |
| B. | C2H4(g)+3O2(g)═2CO2(g)+2H2O(l)△H=+2b kJ•mol-1 | |
| C. | $\frac{1}{4}$C2H4(g)+$\frac{3}{4}$O2(g)═$\frac{1}{2}$CO2(g)+$\frac{1}{2}$H2O(l)△H=+b kJ•mol-1 | |
| D. | C2H4(g)+3O2(g)═2CO2(g)+2H2O(l)△H=-4b kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氯水的颜色呈浅黄绿色,说明氯水中含有HClO | |
| B. | 向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- | |
| C. | 向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ | |
| D. | 向品红溶液中滴加氯水,溶液褪色,说明氯水中含有HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标况下,44.8 L的水中含有H2O分子的数目为2 NA | |
| B. | 常温常压下,22.4 L氢气中含氢原子数目为2 NA | |
| C. | 物质的量浓度为0.5 mol/L的NaCl溶液中,含有Cl-个数为0.5 NA | |
| D. | 5.6 g Fe在足量氯气中完全反应,失去的电子数为0.3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验器材(省略夹持装置) | 相应实验 |
| A | 烧杯、玻璃棒、石棉网、酒精灯 | 浓缩结晶硫酸铜溶液制胆矾 |
| B | 烧杯、玻璃棒、胶头滴管、漏斗、滤纸 | 用盐酸除去硫酸钡中的少量碳酸钡 |
| C | 烧杯、玻璃棒、胶头滴管、容量瓶 | 用固体氯化钠配制100 mL 0.5 mol•L-1的溶液 |
| D | 烧杯、玻璃棒、胶头滴管、分液漏斗 | 用溴水和CCl4除去NaBr溶液中的少量NaI |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
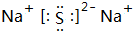 ;W2X2的结构式H-O-O-H.
;W2X2的结构式H-O-O-H.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | c(NO)/mol•L-1 | c(H2)/mol•L-1 | 速率/mol•L-1•min-1 |
| Ⅰ | 0.0060 | 0.0010 | 1.8×10-4 |
| Ⅱ | 0.0060 | 0.0020 | 3.6×10-4 |
| Ⅲ | 0.0010 | 0.0060 | 3.0×10-5 |
| Ⅳ | 0.0020 | 0.0060 | 1.2×10-4 |
| A. | 整个反应速度由第①步反应决定 | |
| B. | 正反应的活化能一定是①<② | |
| C. | 该反应速率表达式:v=5000c2(NO)•c(H2) | |
| D. | 该反应的热化学方程式为2NO(g)+2H2(g)═N2(g)+2H2O(g)△H=-664kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com