
| A. | NaAt易溶于苯和四氯化碳等有机溶剂 | |
| B. | At的最高化合价为+7价 | |
| C. | At2是一种有色固体,与H2反应十分缓慢 | |
| D. | AgAt是有色固体,见光易分解 |
分析 A.卤素单质中溴、碘都易溶于有机溶剂,其钠盐都是易溶于水的盐;
B.根据同一主族元素化合价的相似性判断;
C.卤族元素单质是有色物质,从上到下颜色加深,氧化性减弱;
D.卤族元素的卤化银都难溶于水,结合溴化银、碘化银见光易分解来回答.
解答 解:A.卤素单质中溴、碘都易溶于有机溶剂,但是其钠盐都是易溶于水的盐,故A错误;
B.砹属于卤族元素,卤族元素除F没有正价外,其它的最高价均为+7价,故B正确;
C.卤族元素单质是有色物质,从上到下颜色加深,氧化性减弱,得到:At2是一种有色固体,与H2反应十分缓慢,故C正确;
D.卤族元素的卤化银都难溶于水,所以AgAt是有色固体,根据溴化银、碘化银见光易分解可以推知:AgAt见光易分解,故D正确.
故选A.
点评 本题考查了同一主族元素形成的相似性,利用已知元素的性质,根据元素周期律来确定未知元素及其化合物的性质,采用知识迁移的方法进行解答,难度不大.


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案 期末好成绩系列答案
期末好成绩系列答案科目:高中化学 来源: 题型:选择题
| A. | 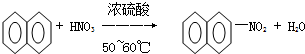 | |
| B. |  | |
| C. | CH3CHO+H2$→_{催化剂}^{高温高压}$CH3CH2OH | |
| D. | 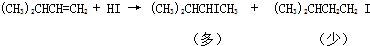 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡溶液与硫酸的反应OH-+H+═H2O | |
| B. | 澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+═Ca2++2H2O | |
| C. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| D. | 铝粉投入到NaOH溶液中:2Al+2OH-+2H2O═2AlO2-+3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
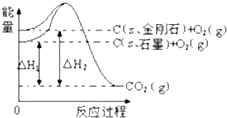
| A. | 石墨转化为金刚石需吸热 | B. | 石墨和金刚石的转化是物理变化 | ||
| C. | 金刚石的稳定性强于石墨 | D. | 石墨和金刚石是同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 四 | ⑨ | ⑩ |
 .
. ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.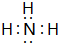 ,该化合物是由极性(填“极性”或“非极性”)键形成的.
,该化合物是由极性(填“极性”或“非极性”)键形成的.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池中,负极上发生的反应是还原反应 | |
| B. | 原电池中,电流的方向是负极-导线-正极 | |
| C. | 双液原电池中的盐桥是为了联通电路,所以也可以用金属导线代替 | |
| D. | 在原电池中,阳离子移向正极,阴离子移向负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com