
【题目】有关物质的转化关系如图所示。A的摩尔质量为120 g·mol1且只含两种元素。B、E是常见气体,其中B为单质,E能使品红溶液褪色。D为红棕色固体,F为紫红色金属,C的浓溶液可干燥某些气体。

(1)A的化学式为______。
(2)H的电子式为______。
(3)写出反应③的离子方程式:______。
(4)写出反应④的化学方程式:______。
【答案】FeS2 ![]() 2Fe3++Cu=2Fe2++Cu2+ Fe2(SO4)3+SO2+2H2O=2FeSO4+2H2SO4
2Fe3++Cu=2Fe2++Cu2+ Fe2(SO4)3+SO2+2H2O=2FeSO4+2H2SO4
【解析】
E是常见气体,且E能使品红溶液褪色,则首先考虑E为SO2;D为红棕色固体,则D为Fe2O3;A只含两种元素,B是常见气体,且B为单质,A和B煅烧生成SO2和Fe2O3,则B为O2,A含有Fe、S两种元素,而A的摩尔质量为120 g·mol1,则A为FeS2;C的浓溶液可干燥某些气体,则C为硫酸,Fe2O3与H2SO4反应生成Fe2(SO4)3和水,F为紫红色金属,则F为Cu,Cu可以与Fe2(SO4)3反应生成CuSO4、FeSO4,则G为Fe2(SO4)3,H为H2O;Fe2(SO4)3、H2O、SO2反应生成FeSO4和H2SO4,则J为FeSO4,I为CuSO4,据此分析解答。
(1)由以上分析知,A为FeS2;
故答案为:FeS2;
(2)由以上分析知,H为H2O,其电子式为![]() ;
;
故答案为:![]() ;
;
(3)反应③为Cu与Fe2(SO4)3反应生成CuSO4、FeSO4,离子方程式为2Fe3++Cu=2Fe2++Cu2+;
故答案为:2Fe3++Cu=2Fe2++Cu2+;
(4)反应④为Fe2(SO4)3、H2O、SO2反应生成FeSO4和H2SO4,化学方程式为Fe2(SO4)3+SO2+2H2O=2FeSO4+2H2SO4;
故答案为:Fe2(SO4)3+SO2+2H2O=2FeSO4+2H2SO4。


科目:高中化学 来源: 题型:
【题目】氮有不同价态的氧化物,如NO、N2O3、NO2等,它们在一定条件下可以相互转化。
(1)某温度下,在一体积可变的密闭容器中充入1molN2O3,发生反应N2O3NO2(g)+NO(g),达到平衡后,于t1时刻改变某一条件后,速率与时间的变化图象如图1所示,有关说法
正确的是____
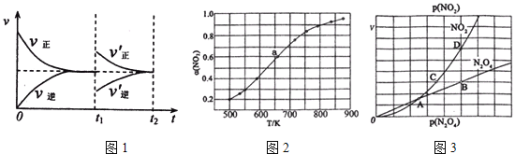
A.t1时刻改变的条件是增大N2O3的浓度,同时减小NO2或NO的浓度
B.t1时刻改变条件后,平衡向正反应方向移动,N2O3的转化率增大
C.在t2时刻达到新的平衡后,NO2的百分含量不变
D.若t1时刻将容器的体积缩小至原容积的一半,则速率~时间图象与上图相同
(2)在1000K下,在某恒容容器中发生下列反应:2NO2(g)2NO(g)+O2(g),将一定量的NO2放入恒容密闭容器中,测得其平衡转化率α(NO2)随温度变化如图所示。
图2中a点对应温度下。已知NO2的起始压强P0为120kPa,列式计算该温度下反应的平衡常数Kp=______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)对于反应N2O4(g)2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2).其中,k1、k2是与反应及温度有关的常数。相应的速率﹣压强关系如图所示:一定温度下,k1、k2与平衡常数Kp间的关系是k1=_____;在图3标出点中,指出能表示反应达到平衡状态的两个点_____,理由是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由γ-羟基丁酸生成γ-丁内酯的反应如下:
![]()
γ-羟基丁酸水溶液的初始浓度为1.50 mol/L,在不同温度下测得γ-羟基丁酸的浓度随时间变化的数据如表所示。回答下列问题:
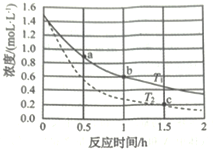
(1)温度T1________T2(大于、小于、相等、不能确定)。
(2)b点时用γ-丁内酯表示的反应速率ν(丁内酯)=_____________。
(3)c点时γ-羟基丁酸的转化率a%=__________。(保留小数点后1位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用下列装置进行乙醇催化氧化的实验.

(1)仪器连接安装完毕,进行实验前如何检验装置的气密性:_____;
(2)实验过程中铜网出现的现象________;
(3)甲和乙两个水浴作用不相同.甲的作用是__;乙的作用是__;.
(4)反应进行一段时间后,试管a中能收集到不同的物质,它们是__,集气瓶中收集到的气体的主要成分是__;
(5) 若试管a中收集到的液用紫色石蕊试纸检验,试纸显红色,说明液体中还含有_____,要除去该物质,可先在混合液中加入______(填写字母),然后,再通过_____(填实验操作名称)即可除去。
a、氯化钠溶液 b、苯 c、碳酸氢钠溶液 d、四氯化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,H2R及其钠盐的溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(α)随溶液pH变化关系如下图所示,下列叙述错误的是
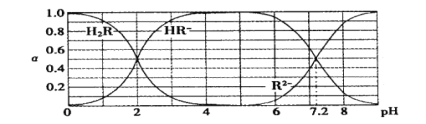
A.H2R是二元弱酸,其Ka1=1×10-2
B.当溶液恰好呈中性时,c( Na + )=2c ( R2- ) + c( HR- )
C.NaHR在溶液中水解倾向大于电离倾向
D.含Na2R与NaHR各0.1 mol的混合溶液的pH=7.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1 mol·L-1氨水中存在如下电离平衡:NH3·H2O ![]() NH4++OH-,对于该平衡,下列叙述正确的是
NH4++OH-,对于该平衡,下列叙述正确的是
A. 加入水时,溶液中c(OH-) 增大
B. 加入少量NH4Cl固体,平衡向逆方向移动,电离平衡常数减小
C. 通入少量HCl气体,溶液中c(NH4+)增大
D. 降低温度,促进NH3·H2O电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式的表达正确的是
A.甲烷与氯气在光照下反应:![]()
B.次氯酸在水中发生电离:HClO + H2O = H3O++ ClO-
C.碳酸钠在水中发生水解:CO32-+ 2H2O![]() H2CO3+ 2OH-
H2CO3+ 2OH-
D.氯化铵在水中发生水解:NH4++ 2H2O![]() NH3.H2O + H3O+
NH3.H2O + H3O+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应速率和化学平衡的说法不正确的是( )
A.对于化学反应来说,反应速率越快,反应现象不一定越明显
B.N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,其他条件不变时,升高温度,反应速率υ(H2)和氢气的平衡转化率均增大
2NH3(g) ΔH<0,其他条件不变时,升高温度,反应速率υ(H2)和氢气的平衡转化率均增大
C.化学反应速率理论可指导怎样在一定时间内快出产品,化学平衡理论可指导怎样用有限的原料多出产品
D.CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题组采用活性炭回收海带化工提碘废水中残留的低浓度碘(主要以I﹣形式存在,杂质不参与反应),实验过程如图所示,下列说法错误的是

A.操作X的目的是富集碘单质
B.可通过蒸馏的方法提纯粗碘
C.经洗脱后的溶液中,含有大量的I-和![]()
D.氧化步骤发生反应的离子方程式为:6I-+2![]() +8H+=3I2+N2↑+4H2O
+8H+=3I2+N2↑+4H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com