
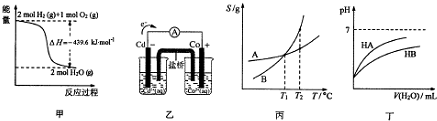
| A. | 由甲推知氢气的燃烧热为219.8kJ•mol-1 | |
| B. | 由乙推知离子反应Co2+(ap)+Cd(s)═Co(s)+Cd2+(ap)可以发生 | |
| C. | 由丙可知:将A、B饱和溶液分别由T1℃升温T2℃时,溶质的质量分数:B>A | |
| D. | 由丁可知:同温度、同浓度NaA溶液与NaB溶液相比,其pH:NaA>NaB |
分析 A.1mol氢气完全燃烧生成液态水放出的热量为燃烧热;
B.原电池反应一定是自发的氧化还原反应;
C.A、B饱和溶液在T1℃时溶解度相同,升高温度变成不饱和溶液;
D.酸越弱,其对应的盐水解程度越大.
解答 解:A.1mol氢气完全燃烧生成液态水放出的热量为燃烧热,甲图中生成的产物为气态水,所以不能计算燃烧热,故A错误;
B.原电池反应一定是自发的氧化还原反应,Co2+与Cd能发生原电池反应,则离子反应Co2+(ap)+Cd(s)═Co(s)+Cd2+(ap)可以发生,故B正确;
C.T1℃时,A和B的溶解度相同,饱和溶液中溶质的质量分数相同,当升温到T2℃时,两者的溶解度均变大,无晶体析出,故溶液中的溶质的质量分数均不变,仍相等,故C错误;
D.从图象可以看出,加水稀释时,HA的pH变化大,故HA的酸性强于HB,而酸越弱,其对应的盐越水解,故同温度、同浓度的NaA溶液与NaB溶液相比,NaB的水解程度大,pH更大,其pH前者小于后者,故D错误;
故选B.
点评 本题考查了图象的问题,涉及燃烧热、原电池原理、溶解度、盐的水解和弱电解质的电离等,题目具有一定的综合性,注意把握强、弱电解质稀释时pH的变化.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:选择题
| A. | 盐酸的酸性比氢硫酸(H2S水溶液)酸性强 | |
| B. | Cl2与铁反应生成FeCl3,而S与铁反应生成FeS | |
| C. | Cl2能与H2S反应生成S | |
| D. | 还原性:Cl-<S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
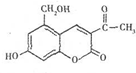
| A. | 亮菌甲素分子式为C12H11O5,属于稠环芳香烃 | |
| B. | 亮菌甲素具有弱酸性,说明羟基对苯环有影响 | |
| C. | 1mol亮菌甲素最多能与2molNaOH发生反应 | |
| D. | 1mol亮菌甲素最多能与5molH2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 W、X、Y、Z是原子序数依次增大的四种短周期元素,已知:元素W的一种原子的原子核中没有中子;元素X 构成的某种单质在自然界中硬度最大;元素Z在地壳中含量最高.试回答下列各题:
W、X、Y、Z是原子序数依次增大的四种短周期元素,已知:元素W的一种原子的原子核中没有中子;元素X 构成的某种单质在自然界中硬度最大;元素Z在地壳中含量最高.试回答下列各题: CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
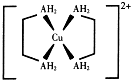 铜及其化合物在现代生活中应用广泛.
铜及其化合物在现代生活中应用广泛.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2O2和C3H6O2一定互为同系物 | |
| B. | 碳酸钠溶液可用于鉴别乙酸和乙酸乙酯 | |
| C. | 用溴水可以除去溶解在苯中的少量苯酚 | |
| D. | 粮食酿酒过程中,淀粉在酶的催化作用下最终水解为乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
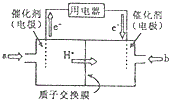 二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或H2SO4反应生成SeO2以回收Se.完成下列填空:
二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或H2SO4反应生成SeO2以回收Se.完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
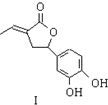 内酯类化合物在药物、涂料等应用广泛.
内酯类化合物在药物、涂料等应用广泛. +$\frac{1}{2}$O2+CO2$\stackrel{催化剂}{→}$
+$\frac{1}{2}$O2+CO2$\stackrel{催化剂}{→}$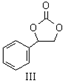
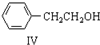 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$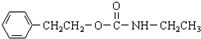 +H2O
+H2O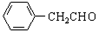 ;由IV生成II的反应条件为浓硫酸、加热.
;由IV生成II的反应条件为浓硫酸、加热.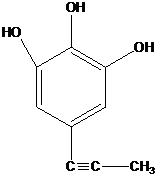 .
.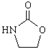 ,涉及的反应方程式为BrCH2CH2-NH2+NaOH$→_{△}^{H_{2}O}$HOCH2CH2NH2、HOCH2CH2NH2+CO2$\stackrel{催化剂}{→}$
,涉及的反应方程式为BrCH2CH2-NH2+NaOH$→_{△}^{H_{2}O}$HOCH2CH2NH2、HOCH2CH2NH2+CO2$\stackrel{催化剂}{→}$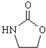 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同分异构体因结构不同,化学性质一定差别很大 | |
| B. | 具有相同通式的有机物不一定互为同系物 | |
| C. | 两个相邻同系物的相对分子质量数值一定相差14 | |
| D. | 同分异构体不可能互为同系物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com