
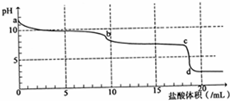
 常温下,用0.2mol•L-1HCl溶液滴定10mL浓度为0.2mol•L-1 Na2CO3溶液,所得滴定曲线如图所示.下列说法不正确的是( )
常温下,用0.2mol•L-1HCl溶液滴定10mL浓度为0.2mol•L-1 Na2CO3溶液,所得滴定曲线如图所示.下列说法不正确的是( )| A. | a点时:c(H+)+c(HCO3-)+2c(H2CO3)=c(OH-) | |
| B. | 当盐酸加入5mL时:c(CO32-)+c(HCO3-)+c(H2CO3)=2c(Cl-) | |
| C. | 当盐酸加入10mL时:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| D. | b-c段发生的反应为:HCO3-+H+=CO2↑+H2O |
分析 A.a点为碳酸钠溶液,根据碳酸钠溶液中的质子守恒判断;
B.根据混合液中物料守恒分析;
C.当盐酸加入10mL时,反应恰好生成碳酸氢钠,碳酸氢根离子的电离程度小于其水解程度,则c(H2CO3)>c(CO32-);
D.b点加入10mL盐酸后生成碳酸氢钠,所以b-c段碳酸氢根离子与氢离子反应生成二氧化碳气体和水.
解答 解:A.a点加入盐酸的体积为0,则a点为碳酸钠溶液,根据碳酸钠溶液中的质子守恒可得:c(H+)+c(HCO3-)+2c(H2CO3)=c(OH-),故A正确;
B.滴定过程中溶液中存在物料守恒:2c(CO32-)+2c(HCO3-)+2c(H2CO3)=c(Na+),当盐酸加入5mL时,则c(Na+)=2c(Cl-),则:c(CO32-)+c(HCO3-)+c(H2CO3)=2c(Cl-),故B正确;
C.滴入10mL盐酸时,恰好反应生成碳酸氢钠,由于HCO3-的水解程度大于其电离程度,则c(H2CO3)>c(CO32-),正确的离子浓度大小为:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-),故C错误;
D.根据图象可知,滴入10mL盐酸时,恰好反应生成碳酸氢钠,则b-c段碳酸氢钠与盐酸反应生成二氧化碳气体,反应的离子方程式为:HCO3-+H+=CO2↑+H2O,故D正确;
故选C.
点评 本题考查了离子浓度大小比较、酸碱混合的定性判断,题目难度中等,明确反应后溶质组成为解答关键,注意掌握电荷守恒、物料守恒、质子守恒及盐的水解原理的含义及应用,试题侧重考查学生的分析、理解能力.


科目:高中化学 来源: 题型:选择题
| A. |  三种氨基酸脱水,最多可生成6种二肽 三种氨基酸脱水,最多可生成6种二肽 | |
| B. | 戊烷、戊醇、戊烯、乙酸乙酯中同分异构体数目最少的是戊烯 | |
| C. | 分子式为C5H12O且可与金属钠反应放出氢气的有机化合物有8种 | |
| D. | 将2-丙醇与NaOH的醇溶液共热可制备CH3-CH=CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 下表各组物质中,通过一步反应不能实现如图所示转化的是( )
下表各组物质中,通过一步反应不能实现如图所示转化的是( )| 选项 | a | b | c |
| A | Al2O3 | NaAlO2 | Al(OH)3 |
| B | CO2 | Na2CO3 | NaHCO3 |
| C | NO | NO2 | HNO3 |
| D | Fe2O3 | FeCl3 | FeCl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 运用化学反应原理研究部分单质及其化合物的反应有重要意义.
运用化学反应原理研究部分单质及其化合物的反应有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| X | 由X形成的单质是最清洁的能源 |
| Y | Y的基态原子核外P能级电子数比S能级少一个 |
| Z | 由Z形成的多种单质,其中之一是地球的“保护伞” |
| W | W的基态原子核外最外层只有1个电子,是人类社会最早使用的货币金属 |
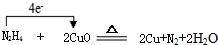 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L | B. | 0.2mol/L | C. | 0.8mol/L | D. | 1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯碱可用于生产普通玻璃,可用纯碱除去物品表面的油污 | |
| B. | 盐卤点豆腐、明矾净水与胶体的性质有关 | |
| C. | 高温条件下可杀死H7N9型禽流感病毒,属于蛋白质的变性 | |
| D. | 新型材料聚酯纤维、光导纤维都属于有机高分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④①③⑤ | B. | ④②①⑤③ | C. | ⑤③①④② | D. | ②④⑤①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 最高价氧化物水化物的酸性:乙<丁 | |
| B. | 甲形成化合物种类最多的元素 | |
| C. | 戊元素位于第4周期第VIIB族 | |
| D. | 乙、丙的最高价氧化物的水化物可以反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com